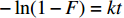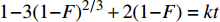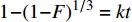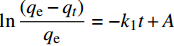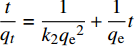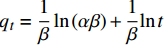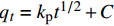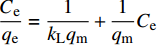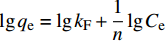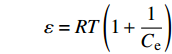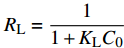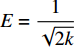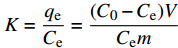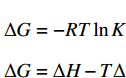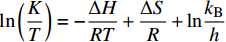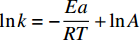Preparation of CaC2O4-direct claret B/chitosan composite materials and adsorption properties for ethyl violet
-
摘要: 以壳聚糖(CTS)和草酸钙-直接枣红B(CaC2O4-DB)杂化材料为原料,采用共混原位固载法制备草酸钙-直接枣红B/壳聚糖(CaC2O4-DB/CTS)复合材料。利用SEM、BET和FTIR对 CTS 和CaC2O4-DB/CTS的形貌及结构等进行表征分析,CaC2O4-DB的固载并未改变CTS的形貌结构,仅增加其比表面积和结合位点。详细考察了吸附时间、乙基紫 (Ethyl violet,EV)初始浓度、溶液pH及温度等因素对CaC2O4-DB/CTS吸附EV的影响,初步探讨了CaC2O4-DB/CTS对EV的吸附动力学和吸附热力学行为。结果表明,CaC2O4-DB/CTS吸附EV在3 h内达到吸附平衡,且pH=8、投加量为6 g/L时,25℃的100 mg/L EV溶液(化学需氧量(COD)为187 mg/L)染料去除率高达95%,COD去除率达90%以上。该吸附过程是自发进行的,符合Langmuir等温线模型和准二级动力学模型,其吸附过程由颗粒内扩散和化学吸附共同控制。Abstract: A composite adsorbent of CaC2O4-DB/CTS was prepared using chitosan (CTS) and the hybrid materials of CaC2O4 and direct claret B (CaC2O4-DB/CTS) by the method of blending in-situ immobilization. CTS and CaC2O4-DB/CTS were characterized by SEM, BET and FTIR. The immobilization of CaC2O4-DB only increases the specific surface area and binding sites without changing the morphology and structure of CTS. The effects of adsorption time, the initial concentration of ethyl violet (EV), pH and temperature of the solution on the adsorption properties of CaC2O4-DB/CTS composite material were investigated in detail, and the adsorption kinetics and thermodynamic behavior of EV on CaC2O4-DB/CTS were preliminarily discussed. The results show that the removal rate of dye and chemical oxygen demand (COD) reach 95% and 90% for 100 mg/L EV solution (COD is 187 mg/L), respectively, under conditions of room temperature, CaC2O4-DB/CTS dosage of 6 g/L, adsorption time of 3 h and pH=8. The adsorption behavior of EV by the adsorbent is spontaneous and in accordance with Langmuir model and the quasi-second-order kinetic model. The adsorption process is controlled by intra-particle diffusion and the chemical adsorption.
-
Keywords:
- chitosan /
- composite materials /
- adsorption /
- kinetics /
- thermodynamics /
- ethyl violet
-
近年来,纺织、造纸、印刷、食品和化妆品等行业迅速发展,导致含有大量染料的废水产生和排放。水体中的染料具有难降解、毒性大、抗氧化等特点,被认为是极难处理的污染物之一。水体中少量染料的存在即可引起水体变色,降低水体透光度,导致水体生态环境恶化;染料本身或其降解产物可通过食物链间接危害人类健康[1]。目前,常用的染料废水处理方法有电化学法、光催化法、生物氧化法及吸附法等。吸附法因操作简便、吸附剂种类多、能耗低而倍受关注[2]。因此,研发吸附效果好、成本低廉的新型吸附材料具有重要的实际意义以及广阔的市场前景。
有机/无机杂化材料是一种由有机物和无机物通过包埋、聚沉、化学交联等物理或化学作用相结合的材料。在微观尺寸上,该杂化材料通过有机和无机组分相结合,使其兼具两种组分的优点。相比传统的复合材料,该杂化材料有突出的性能与功能优势[3],在废水处理方面得到了广泛的研究和应用[4]。壳聚糖(Chitosan,CTS)通过分子中的氨基、羟基,可与金属离子Pb2+、Hg+、Ni2+等形成稳定的螯合物,因而常作为一种用于重金属工业废水处理的吸附材料[5-6]。然而,由于其存在力学性能低、加工难度大、可重复利用性差等缺点,其应用受到一定限制。查阅文献可知,将有机/无机杂化材料掺入CTS溶液,通过共混原位固载法制备复合吸附材料,两者的协同作用不仅可提高材料的吸附性能,而且可增加材料的力学性能和拉伸强度,从而拓宽该类材料的应用范围[7]。
本文采用无机骨架CaC2O4和有机染料配体直接枣红B(DB)制备CaC2O4-DB(CaC2O4-DB)有机/无机杂化材料,将其与CTS溶液混合,通过共混原位固载法制备一种新型三维多孔复合凝胶微球CaC2O4-DB/CTS作吸附剂,考察了CaC2O4-DB/CTS对乙基紫(Ethyl violet,EV)的吸附动力学和热力学行为,同时探究染料初始浓度、溶液pH、温度、作用时间等因素对CaC2O4-DB/CTS吸附EV性能的影响,以期开发一种低成本、高效环保的染料废水吸附材料。
1. 实验材料及方法
1.1 CaC2O4-DB/CTS的制备
根据文献[8]的制备方法,按摩尔比n(Ca2+)∶n(C2O42−)∶n(DB)=2∶1∶0.03的配比投加原料,制备草酸钙-直接枣红B杂化材料(CaC2O4-DB)。采用原位共混原位固载法,将一定浓度的CaC2O4-DB与CTS溶液混合均匀,用医用针筒吸取一定量混合溶液,采用柱滴法将混合溶液滴入6 wt%多聚磷酸钠溶液中,固化反应1 h。取出凝胶微球,用去离子水清洗3次,得到复合凝胶微球CaC2O4-DB/CTS。测定其固含量后,贴上标签备用。
1.2 CaC2O4-DB/CTS对EV的吸附实验
在不同pH、时间、温度、染料初始浓度和CaC2O4-DB/CTS投加量等条件下,将CaC2O4-DB/CTS微球加入到一定量的EV溶液中,振荡一定时间后,取其上层清液至离心管中,在10000 r/min下离心10 min,采用紫外-可见分光光度计(DR5000,美国哈希科学仪器有限公司)测定离心后上层清液的吸光度。
CaC2O4-DB/CTS对EV吸附的去除率R和平衡吸附量qe(mg·g−1)按下式计算:
R=Co−CtCo×100% qe=(Co−Ce)⋅Vm 其中:Co、Ct、Ce分别为EV染料的初始浓度、吸附t时间后的浓度和吸附平衡浓度(mg·L−1);V为溶液体积(L);m为吸附剂投加量(g)。
2. 结果与讨论
2.1 CaC2O4-DB/CTS材料形貌和结构
2.1.1 CaC2O4-DB/CTS微观形貌
图1中,图1(a)和图1(a1)是CTS凝胶微球表面放大2 000倍和50000倍的SEM图像。可见微球表面多为致密的小孔结构。由CTS微球切面的SEM图像(图1(b)和图1(b1))可看出CTS微球的内部呈网状多孔结构,其比表面积为21.82 m2/g。相比之下,从CaC2O4-DB/CTS复合凝胶微球表面(图1(c))和切面(图1(c1))分别放大2 000倍和50000倍的SEM图像可以看出,CaC2O4-DB/CTS吸附材料的表面和内部均呈现为疏松多孔的荆棘状结构,这是由于CaC2O4-DB/CTS微球表面及内部成功固载CaC2O4-DB杂化吸附材料的颗粒(图1(d)),产生更多、更小且孔径大小不一的三维多孔网状结构,其比表面积为24.56 m2/g。CaC2O4-DB被CTS成功固载,一方面,所形成的三维多孔结构增大了吸附剂的比表面积和吸附位点;另一方面,由于CaC2O4-DB杂化材料自身具有较强的吸附性能,有利于CaC2O4-DB/CTS微球捕捉水中的染料分子,增加吸附量[9]。
![]() 图 1 各种材料SEM图像:(a) 壳聚糖(CTS)材料表面;(b) CTS材料切面;(c) CaC2O4-直接枣红B(DB)/CTS材料表面;(a1) CTS材料表面局部放大图;(b1) CTS材料切面局部放大图;(c1) CaC2O4-DB/CTS材料切面;(d) CaC2O4-DB材料Figure 1. SEM images of chitosan (CTS) ((a), (b)), CaC2O4-direct claret B (DB)/CTS (c) and CaC2O4-DB (d), area of CaC2O4-DB materials (a1), CTS materials (b1), CaC2O4-DB/CTS materials (c1)
图 1 各种材料SEM图像:(a) 壳聚糖(CTS)材料表面;(b) CTS材料切面;(c) CaC2O4-直接枣红B(DB)/CTS材料表面;(a1) CTS材料表面局部放大图;(b1) CTS材料切面局部放大图;(c1) CaC2O4-DB/CTS材料切面;(d) CaC2O4-DB材料Figure 1. SEM images of chitosan (CTS) ((a), (b)), CaC2O4-direct claret B (DB)/CTS (c) and CaC2O4-DB (d), area of CaC2O4-DB materials (a1), CTS materials (b1), CaC2O4-DB/CTS materials (c1)2.1.2 CaC2O4-DB/CTS微观结构
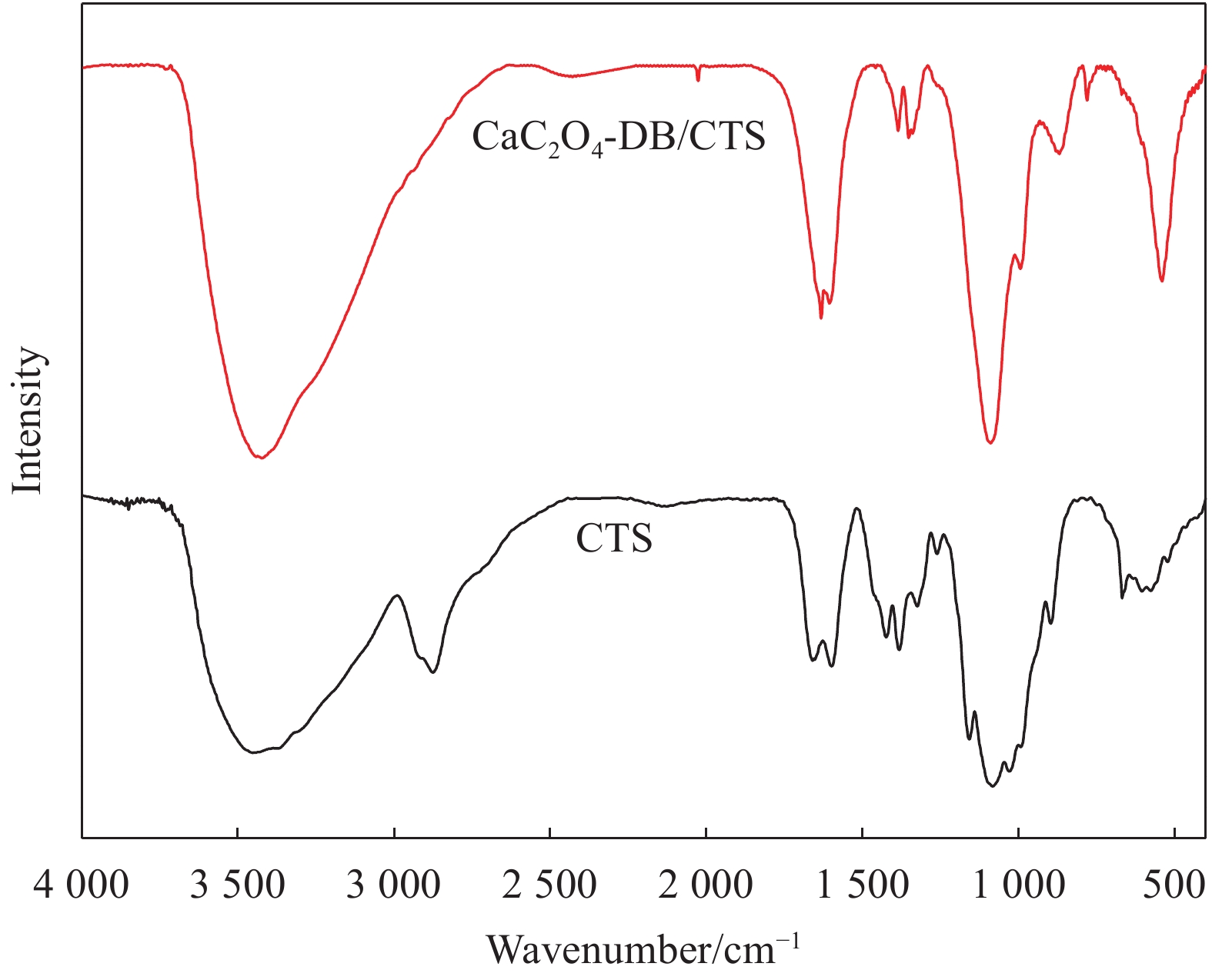
图2为CTS及CaC2O4-DB/CTS材料的FTIR图谱。可以看出,CaC2O4-DB/CTS材料在3674~2784 cm−1、1630 cm−1、1369 cm−1处具有特征吸收峰。与CTS相比,CaC2O4-DB/CTS材料吸收峰的位置大致没有变化,但是峰值强度增加。3420 cm−1处的吸收峰是由CTS的—OH和—NH2的伸缩振动重叠所引起的,1650 cm−1处为酰胺Ⅰ带的特征吸收峰;1599 cm−1处为N—H的弯曲振动峰,2874 cm−1、1427 cm−1、1378 cm−1、1080 cm−1处的峰则与脂肪C—H键、O—H键、—CH3对称变形振动及环内C—O—C的伸缩振动有关[10]。CaC2O4-DB/CTS材料在3420 cm−1处的峰值强度大于CTS,说明CaC2O4-DB的介入使CaC2O4-DB/CTS材料游离的—OH和—NH2增多,吸附位点增加,有利于结合染料分子。原有的酰胺Ⅰ带和N—H弯曲振动峰消失,并在1635 cm−1处出现新的吸收峰,表明CTS原有的氨基与CaC2O4-DB结合[11]。结合SEM图像,可知CTS对CaC2O4-DB的固载,并未改变CTS原有的形貌结构,仅增加了活性位点。
2.2 CaC2O4-DB/CTS对EV的吸附条件
2.2.1 CaC2O4-DB/CTS投加量
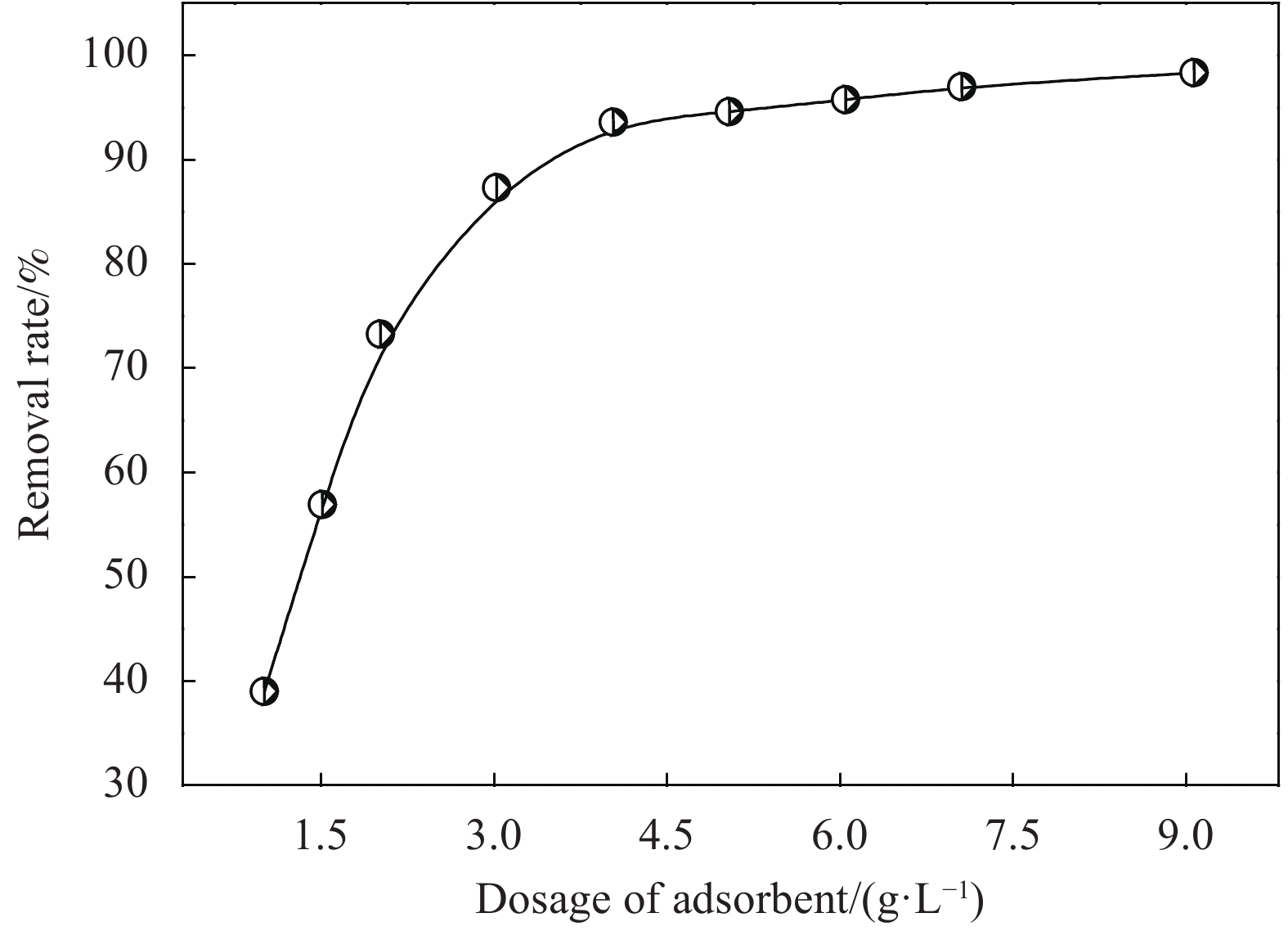
图3为CaC2O4-DB/CTS投加量对EV吸附的影响。可知,CaC2O4-DB/CTS投加量在1.2~4.0 g/L区间增加时,EV去除率随投加量的增加而明显提高。继续增加投加量,EV去除率趋于平缓。其原因可能为初始阶段增大CaC2O4-DB/CTS投加量,可提供充足的吸附位点以吸附染料,从而提高EV去除率;进一步增加吸附剂的投加量,提供更多的活性位点,此时溶液中大部分染料已被CaC2O4-DB/CTS吸附,溶液中存在染料的吸附和解吸平衡,使吸附剂大多数活性位点变得无效。
2.2.2 EV初始浓度
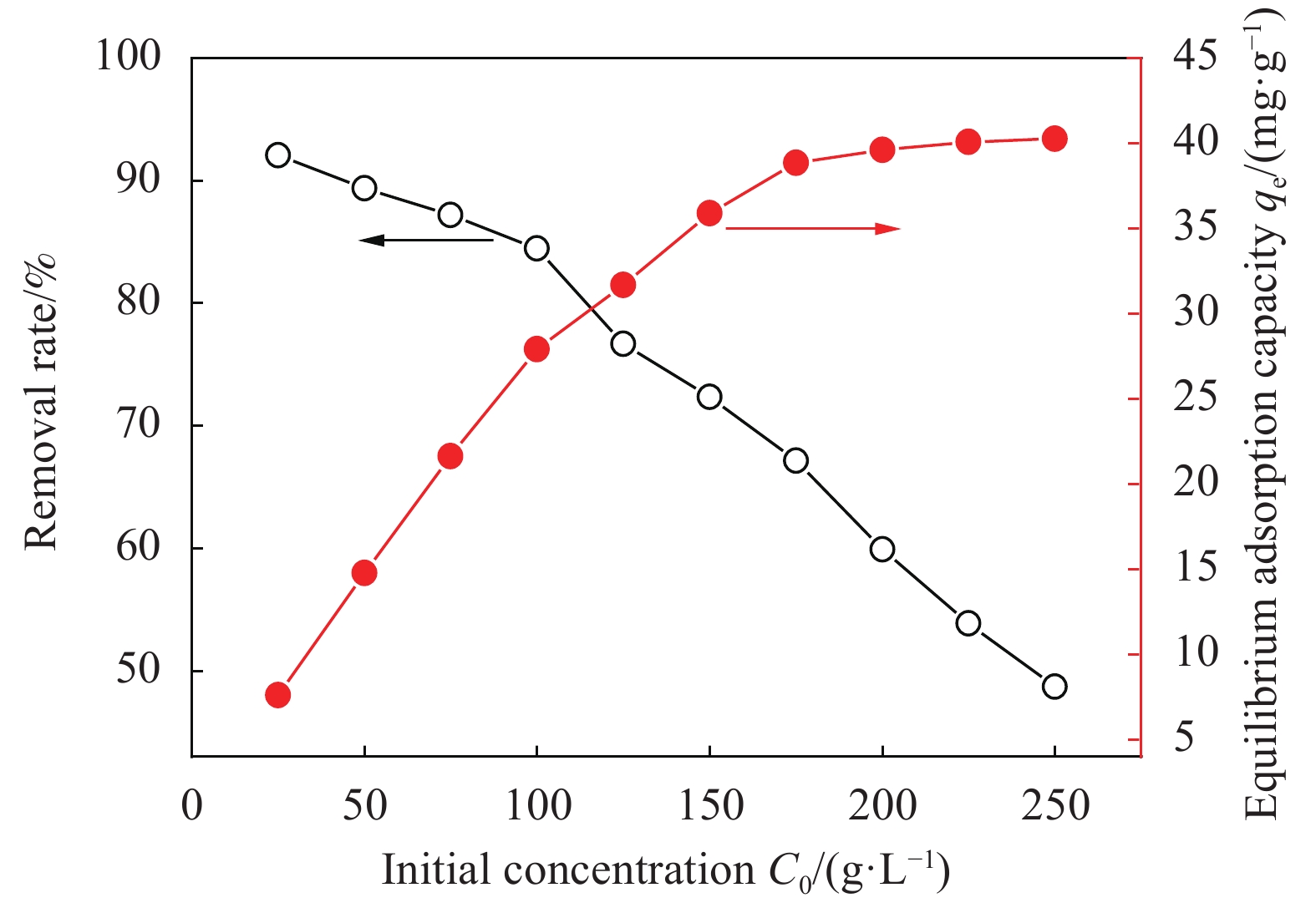
图4为EV初始浓度对CaC2O4-DB/CTS吸附的影响。可知,当EV初始浓度C0在25~250 mg·L−1区间内增加时,EV去除率有明显的下降趋势。染料初始浓度增加,会使溶液中未被吸附的染料分子数量增加,导致去除率下降。CaC2O4-DB/CTS的吸附量随染料初始浓度的增大而增大,这是由于染料的浓度越高,染料分子和材料表面接触的概率提高,有利于充分利用材料的吸附位点;同时较高的浓度可以促进EV分子与材料之间的静电作用及染料在吸附剂内部的扩散,从而吸附更多的染料[12]。一定量吸附材料的吸附位点数量是一定的,当达到吸附平衡时,吸附量达到最大值。
2.2.3 吸附时间
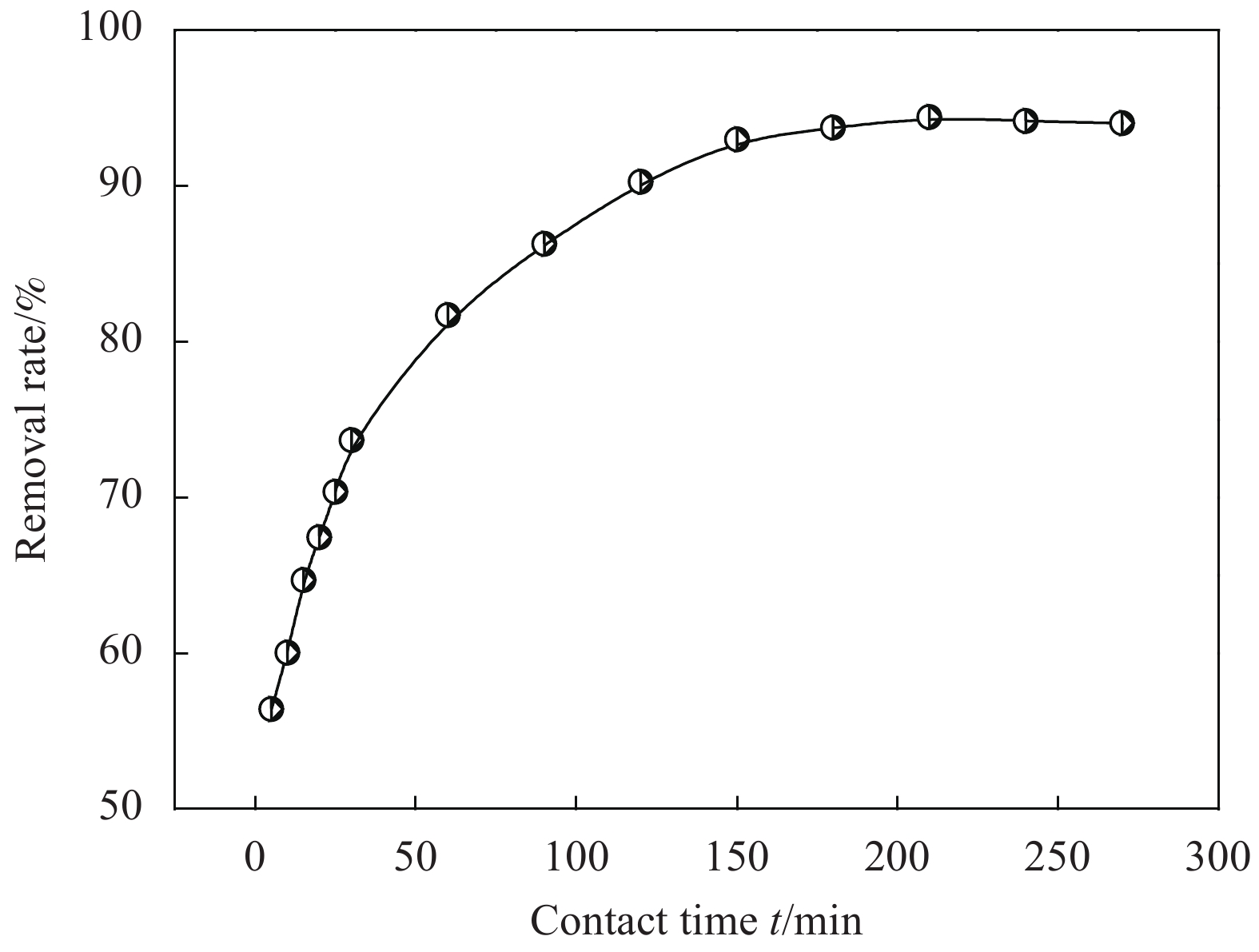
图5为吸附时间对CaC2O4-DB/CTS吸附效果的影响。可知,CaC2O4-DB/CTS材料对EV的吸附过程可分为快速、慢速和动态平衡3个阶段。0~120 min为快速吸附阶段,曲线的斜率较大,去除效果显著,这是由于吸附材料表面存在大量游离的羟基和氨基,吸附位点多,推动力大,染料吸附较快,该过程吸附量约占总平衡吸附量的95%。120~180 min为慢速吸附阶段,瞬时吸附速率减小,其原因可能是微球表面吸附位点越来越少,且固体表面吸附的染料分子与溶液中染料分子间的静电斥力增大,不利于进一步吸附,导致去除率增加不明显[13]。180 min后,吸附位点基本达到饱和,吸附过程达到动态平衡,去除率无明显变化。故CaC2O4-DB/CTS材料对EV吸附平衡时间为180 min。
2.2.4 温 度
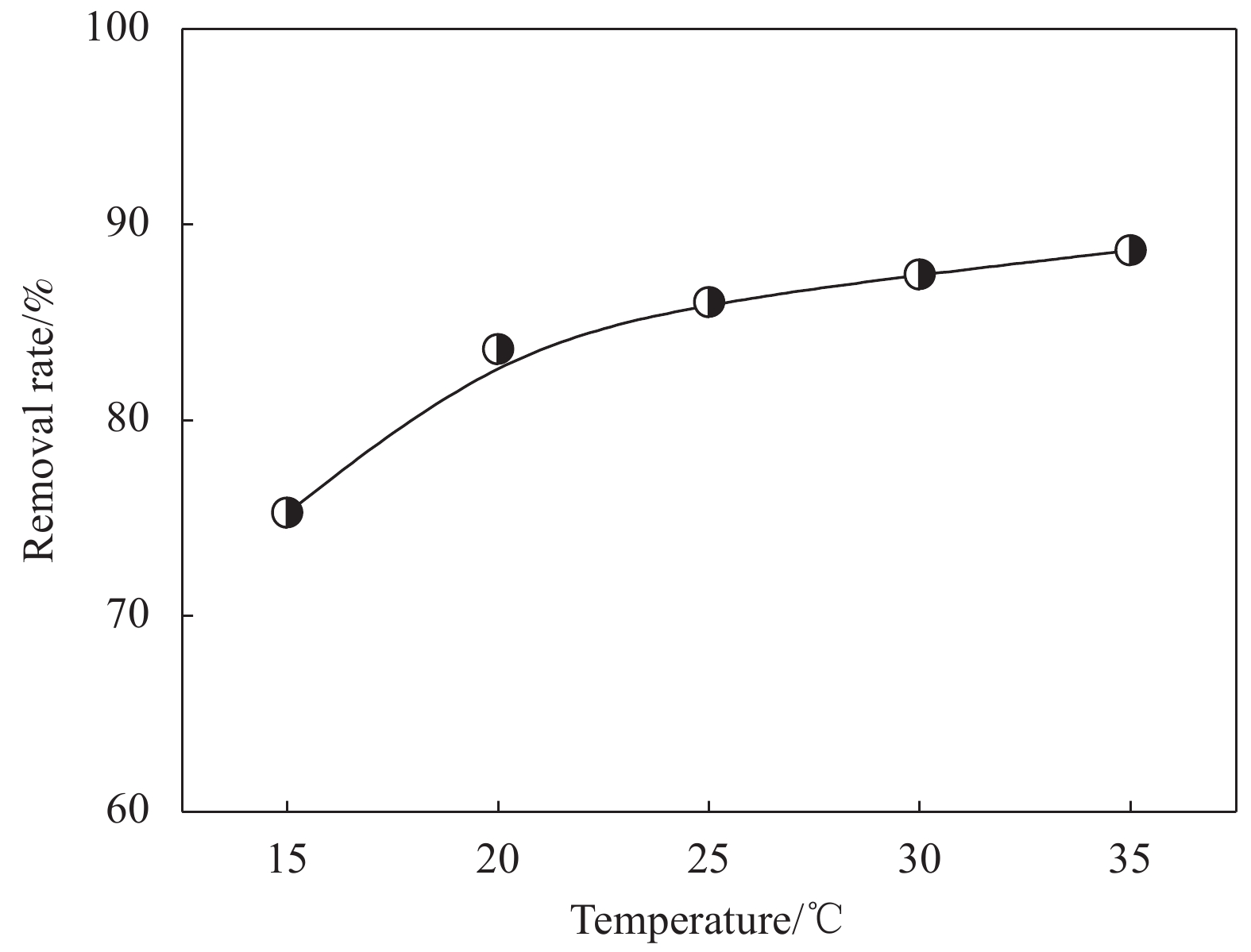
图6为温度对CaC2O4-DB/CTS吸附效果的影响。可知,当温度由15℃升高到35℃时,去除率不断增大,原因可能是:(1) 随着温度升高,染料溶液的黏度下降,EV分子的迁移速率增大;(2) 温度升高有利于EV分子克服静电斥力和空间位阻,吸附更完全。总体来看,温度升高促进EV的吸附,但是作用不明显,因此,CaC2O4-DB/CTS材料对EV吸附可在室温下进行。
2.2.5 体系pH
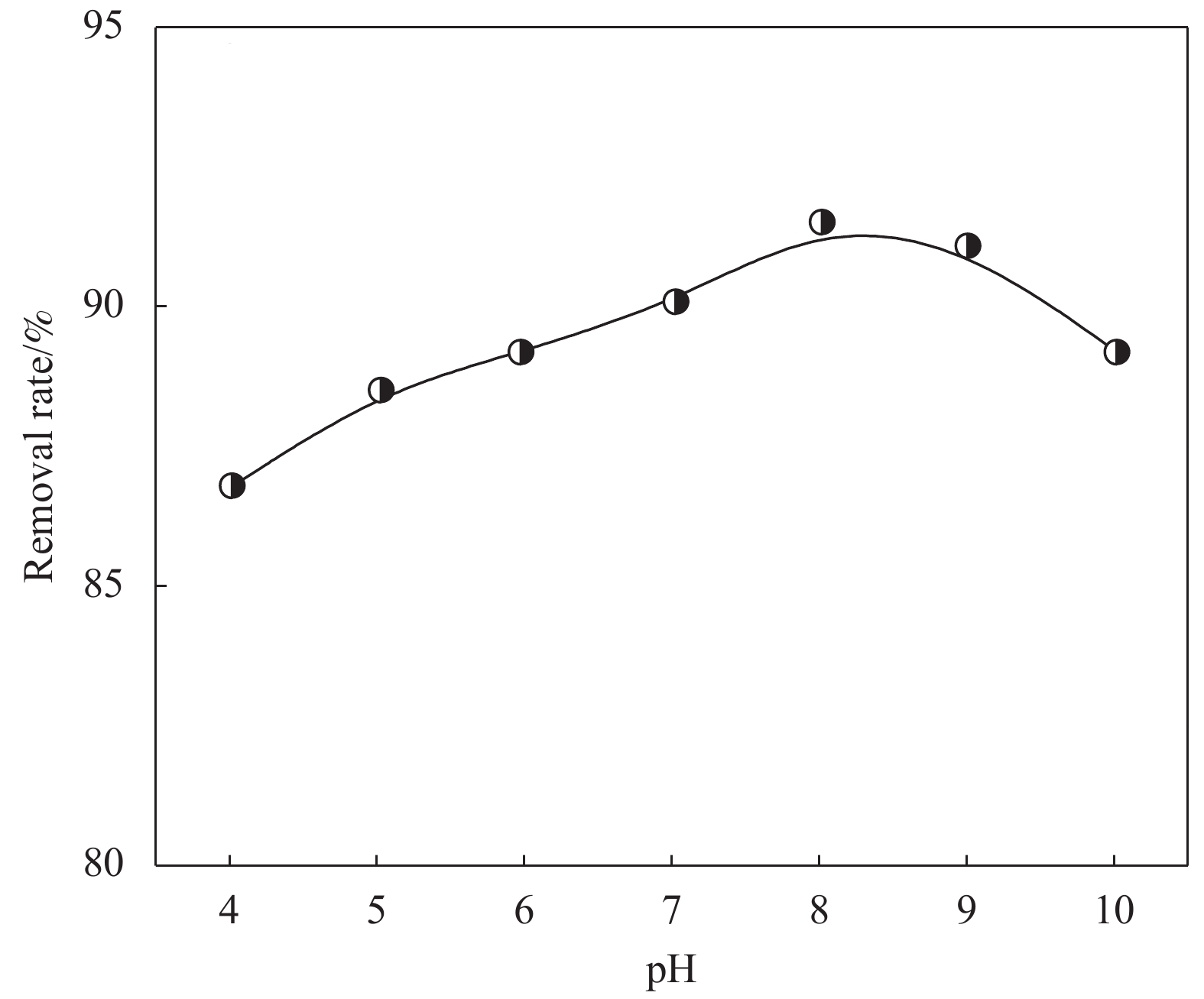
图7为pH对CaC2O4-DB/CTS吸附效果的影响。可知,EV去除率随pH值增大先升高后降低,pH=8达到最大;pH<8或pH>8时,去除率均出现下降的趋势,其可能的原因是:EV属于阳离子染料,酸性条件下的溶液中的H+浓度较大,H+与EV分子竞争吸附位点;同时H+和吸附位点结合,使吸附剂表面的有效负电荷减少,与EV分子间的静电吸引力减弱,从而使EV去除率降低。在pH>8时,OH−与EV结合,阻碍了吸附材料对EV的吸附,同样导致其去除率下降[14];此外,强碱环境会使CaC2O4-DB/CTS吸附材料进一步固化,增强吸附材料的自堆累作用,内部空隙减小,阻碍了吸附质的进入与运输,降低材料的吸附性能[15]。当pH由4增加到10时,去除率在86%~92%区间内变化,起伏小,由此可推断该吸附过程包含由静电引力驱动的离子交换作用,但此作用对吸附效果的影响不大,并不是唯一作用机制。
2.3 动边界模型
动边界模型可用于描述多孔材料的吸附行为,研究固/液体系吸附的控速步骤,一般认为吸附过程包括三个步骤:液膜扩散(染料分子通过外部扩散到吸附剂主体表面)、颗粒内扩散(染料分子在吸附剂内部的扩散)和吸附反应阶段(染料分子以化学或物理方式与吸附剂结合)[16]。其线性表达式分别为
液膜扩散:
−ln(1−F)=kt 颗粒内扩散:
1−3(1−F)2/3+2(1−F)=kt 化学反应:
1−(1−F)1/3=kt 其中:F为离子交换度(F=qt/qe);k为速率常数。
表1为动边界模型拟合参数。可知,−ln(1−F)与t拟合程度最佳,速率常数最小值分别为0.00280、0.00196,故其吸附过程的主要控速步骤为颗粒内扩散和染料分子与活性基团之间的化学反应。分析其原因可能为染料分子与吸附剂表面的活性基团,如—OH、—SO32−,产生范德华作用力,从液体内部快速扩散到吸附剂的表面;接着由于浓差作用,染料分子穿透吸附剂表面大小不一的多孔结构,在吸附剂内部进行扩散,并以化学或物理方式与吸附剂结合,最终达到吸附平衡。
表 1 动边界模型拟合参数Table 1. Parameters of moving boundary model Rate controlling stepMoving boundary model Rate controlling step k R2 Liquid film diffusion 0.01217 0.9643 Intraparticle diffusion 0.00280 0.9341 Chemical reaction 0.00196 0.9319 Notes: k—Constant of rate; R2—Fitting coefficients. 2.4 CaC2O4-DB/CTS杂化材料对EV的吸附动力学
2.4.1 吸附动力学拟合
吸附动力学主要研究吸附速率随时间的变化规律和各种因素对吸附过程的影响。基于Lagergren准一级动力学模型、准二级动力学模型、Elovich模型,对实验数据进行吸附动力学方程的拟合,以探究CaC2O4-DB/CTS杂化材料对EV的吸附原理及吸附类型[17-19]。各模型公式如下:
一级吸附动力学方程:
ln(qe−qt)qe=−k1t+A 二级吸附动力学方程:
tqt=1k2qe2+1qet Elovich模型:
qt=1βln(αβ)+1βlnt 其中:qe为平衡吸附量拟合值(mg·g−1);qt为t时间内对应的吸附量(mg·g−1);kl为一级吸附速率常数(min−1);k2为二级吸附速率常数(g·mg−1·min−1);α是初始吸附速率(g·mg−1·min−1);β是解吸常数(g·mg−1)。
表2为各吸附动力学方程的拟合参数。可看出,准二级动力学方程对CaC2O4-DB/CTS杂化材料吸附EV过程的拟合程度更高,相关系数为0.9995,可推断整个吸附过程更符合准二级动力学吸附模型。通过拟合数据计算的平衡吸附量与实验数据接近,表明吸附过程的限速步骤可能以化学吸附为主[20],吸附速率常数的大小取决于吸附质的浓度[21]。
2.4.2 扩散机制探究
颗粒内扩散模型适用于描述物质在颗粒内部扩散过程的动力学,可以分析吸附过程的控速步骤[22],其方程式如下:
颗粒内扩散方程:
qt=kpt1/2+C 其中:kp为颗粒内扩散速率常数(g·mg−1·min−0.5);C为反应边界层效应的常数。
表3为CaC2O4-DB/CTS对EV吸附颗粒内扩散模型参数。可知,在吸附过程中,颗粒内扩散模型拟合相关系数R2均在0.99以上,说明此模型能够很好地描述染料在吸附材料上的吸附行为。
表 2 CaC2O4-DB/CTS吸附EV各吸附动力学方程的参数Table 2. Kinetics parameters of kinetic models for the adsorption of EV on CaC2O4-DB/CTSFirst-order kinetic model Second-order kinetic model Elovich model qe/(mg·g−1) K1/min−1 R2 qe/(mg·g−1) K2/(g·mg−1·min−1) R2 qe/(mg·g−1) α/(g·mg −1·min−1) R2 13.22 0.0204 0.9682 32.15 0.0311 0.9995 30.63 109.57 0.9858 Notes:qe—Equilibrium adsorption capacity; qt—Adsorption capacity at time t; kl—Rate constant of the pseudo-first-order model; k2—Rate constant of the pseudo-second-order model; β—Desorption constant. 表 3 CaC2O4-DB/CTS对EV吸附颗粒内扩散模型参数Table 3. Parameters of intra-particle kinetic model for the adsorption of EV on CaC2O4-DB/CTSThe first step >The second step >The third step >qt=1.765t1/2+14.51 >qt=0.942t1/2+19.45 >qt=0.209t1/2+28.19 kp C R2 kp C R2 kp C R2 1.765 14.51 0.9933 0.942 19.45 0.9915 0.209 28.19 0.9999 Notes:kp—Constant intra-particle diffusion rate; C—Constant of the reaction boundary layer effect. 一般来说,将qt对t1/2进行线性回归,若直线与坐标轴的交点恰好是原点,那么说明吸附过程仅受颗粒内扩散阶段控制;若直线不过原点,则吸附过程还受其它限速步骤的控制[23]。由图8所示,qt-t1/2曲线分为3个线性阶段,且不通过原点,说明颗粒扩散不是吸附过程的唯一控速步骤,可能还存在液膜扩散和化学反应等共同作用。吸附过程初始阶段的吸附速率较大,在此阶段中,染料浓度较高,固液两相间的浓度梯度大,因此传质推动力较大,吸附速率较快。随着吸附的不断进行,染料被吸附至材料的内表面,溶液中的染料浓度逐渐降低,吸附剂表面的吸附位点逐渐被占据,内扩散阻力不断增大,传质推动力不断减小,吸附速率逐渐降低,这一阶段的吸附过程主要由颗粒内扩散和化学反应两部分共同决定[24]。在吸附后期,由于吸附材料表面的吸附位点趋于饱和,吸附基本达到平衡。
2.5 CaC2O4-DB/CTS杂化材料对EV的吸附等温线
采用Langmuir、Freundlich和Dubinin-Radushkevich(D-R)三种吸附模型对EV等温吸附过程进行分析,根据拟合数据的相关度,可以得到吸附剂与吸附质之间的吸附类型[25]。其公式如下:
Langmuir方程:
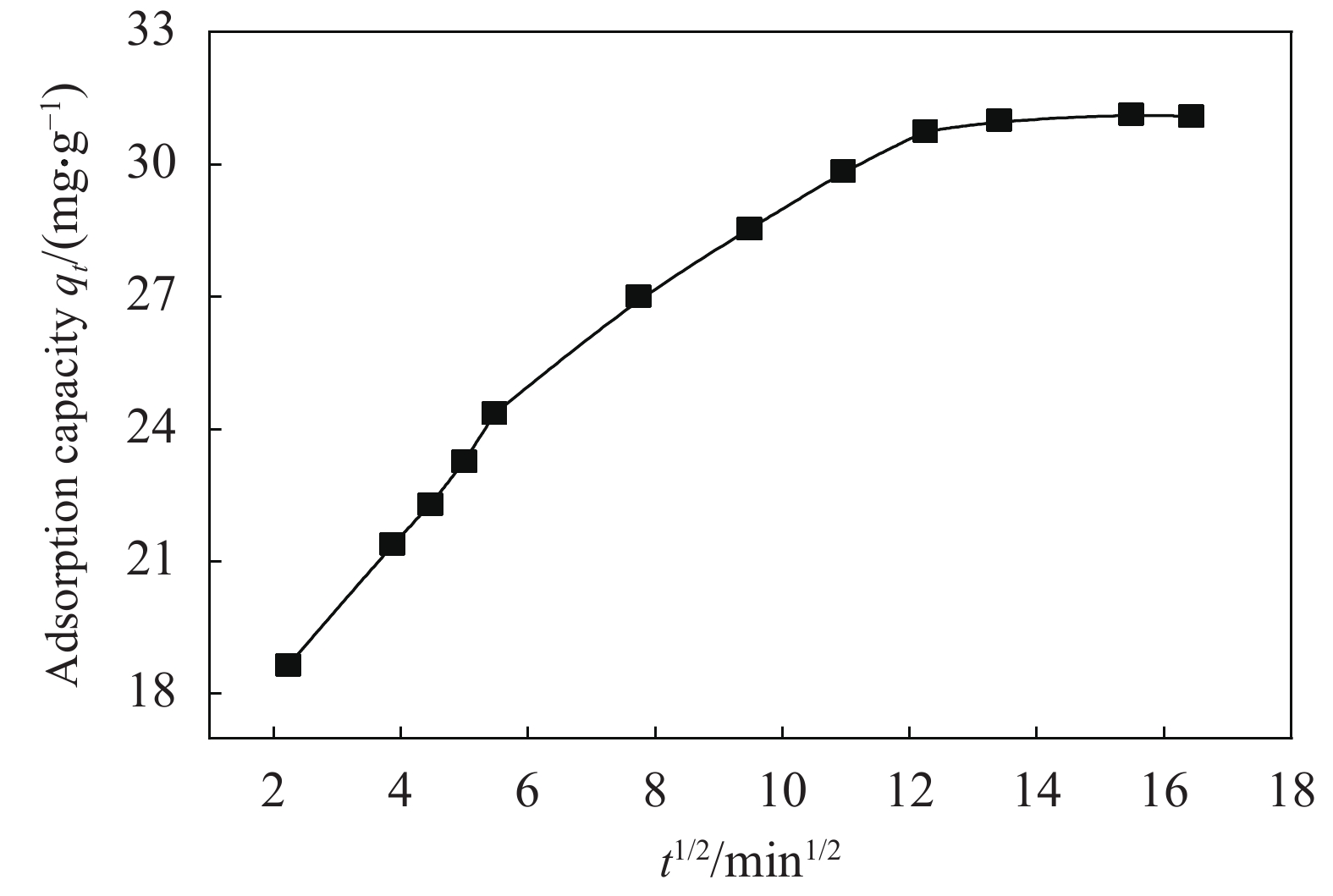
Ceqe=1kLqm+1qmCe Freundlich方程:
lgqe=lgkF+1nlgCe D-R方程:
lnqe=lnqm−kε2 ,ε=RT(1+1Ce) 其中:Ce为平衡浓度(mg·L−1);qm为最大吸附量(mg·g−1);kL为Langmuir常数,kF和n都是Freundlich常数;k是吸附能常数(mol2· kJ−2);ε为Polanyi吸附势能(kJ/mol)。
表4为CaC2O4-DB/CTS对EV等温吸附线参数。可知,在288.15~308.15 K温度范围内,CaC2O4-DB/CTS对EV的等温吸附曲线符合Langmuir吸附等温方程,表明EV与CaC2O4-DB/CTS 结合的方式近似于单分子层吸附;拟合得到的EV在CaC2O4-DB/CTS上的最大吸附容量为40~50 mg·g−1,与实验所得平衡吸附量较接近。
有资料显示,对于Langmuir吸附模型而言,还可以用RL来判断,RL定义如下[26]:
RL=11+KLC0 其中:KL为Langmuir吸附平衡常数(L·mg−1);RL为平衡常数的无量纲系数。
根据RL的计算结果显示,RL的数值都在0~1之间,表明整个吸附过程趋于有利吸附。
由
E=1√2k 可计算平均吸附自由能。当E<8 kJ/mol时,吸附过程为范德华力或氢键影响的物理吸附;当8<E<16 kJ/mol时,反应以离子交换为主;当E>16 kJ/mol时,吸附过程为化学反应[27]。由表4可知CaC2O4-DB/CTS对EV的吸附中,E<8 kJ/mol,表明吸附剂与染料分子的氢键或范德华力为主要的吸附机制,可归因于CaC2O4-DB/CTS表面的羟基与染料分子中的N原子间的氢键和吸附质与染料分子表面的范德华力。随着温度的升高,E逐渐接近8 kJ/mol,可推断该吸附过程中包含离子交换,可归因于吸附质表面的带电基团通过静电引力吸附带相反电荷的染料分子。表 4 CaC2O4-DB/CTS对EV等温吸附线参数Table 4. Isotherm parameters for adsorption of EV on CaC2O4-DB/CTST/K Langmuir model Freundlich model D-R model qm/(mg·g−1) KL/(L·mg−1) R2 KF/(mg·g−1)·
(L·mg−1)1/nn R2 k/(mol2·kJ−2) R2 ε/(kJ·mol−1) 288.15 40.65 0.0768 0.9964 7.72 2.75 0.9842 0.4671 0.9429 5.17 298.15 45.25 0.0959 0.9952 8.85 2.64 0.9285 0.4046 0.9794 5.96 308.15 51.81 0.1092 0.9980 9.62 2.40 0.9458 0.3054 0.9883 7.92 Notes: T—Temperature; qm—Maximumadsorption capacity; KL —Langmuir characteristic constant; KF—Freundlich characteristic constant; n—Freundlich characteristic constant; k—Constant of adsorption energy; ε—Adsorption potential energy. 2.6 CaC2O4-DB/CTS杂化材料对EV的吸附热力学
根据Van’t Hoff方程、Eyring公式和Arrhenius公式[28]对吸附实验结果进行热力学分析,计算吸附过程的吉布斯自由能变ΔG、焓变ΔH和熵变ΔS,以确定吸附过程的热效应和可行性。各公式如下:
K=qeCe=(C0−Ce)VCem ΔG=−RTlnKΔG=ΔH−TΔ Eyring公式:
ln(KT)=−ΔHRT+ΔSR+lnkBh Arrhenius公式:
lnk=−EaRT+lnA 其中:K为吸附平衡常数;kB为玻尔兹曼常数(J·K);h为普朗克常数(J·s)。
表5为CaC2O4-DB/CTS材料吸附EV的热力学参数。可得:(1) ΔG<0,说明CaC2O4-DB/CTS对EV的吸附过程可自发进行,温度升高,ΔG数值越负,说明吸附推动力随温度的升高而增大,即高温有利于吸附[29-30],与前文中温度对吸附效果的影响结果一致;(2) ΔH>0,说明该吸附过程吸热,与Langmuir吸附等温线的拟合结果一致。有研究资料表明,各种作用力引起的吸附热范围分别为:范德华力为4~10 kJ/mol,疏水键力约为5 kJ/mol,氢键为2~40 kJ/mol,偶极间作用力为2~29 kJ/mol,配位基交换约为40 kJ/mol,化学键力大于60 kJ/mol[31]。由拟合结果可知温度主要影响吸附过程中的氢键作用和偶极间作用力,与D-R等温线模型的分析结果吻合;(3) ΔS>0,说明该吸附过程属于熵增的过程,染料分子在吸附剂界面的无序度逐渐增加;(4) 吸附过程的反应活化能Ea=13.037 kJ/mol。若5<Ea<40 kJ/mol,则为物理吸附;若40<Ea<800 kJ/mol,则为化学吸附[32]。则本实验的吸附过程以物理吸附为主导,化学吸附所占比重较小。
表 5 CaC2O4-DB/CTS材料吸附EV的热力学参数Table 5. Isotherm parameters for adsorption of EV on CaC2O4-DB/CTSC0/(mg·L−1) T/K ΔG/(kJ·mol−1) ΔH/(kJ·mol−1) ΔS/(J·(mol·K)−1) 125 288.15-308.15 −2.204 - −4.412 27.5228 0.1031 150 −1.598 - −3.393 22.5636 0.0839 175 −0.9234 - −2.810 24.5821 0.0887 Notes: C0—Initial concentration; ΔG—Gibbs free energy change; ΔH—Enthalpy change; ΔS—Entropy change. 2.7 实际染料废水处理
以重铬酸钾(CODCr)为指数测定废水化学需氧量(COD)。移取一定量的实际EV染料废水(COD=187.64 mg·L−1),加入不同量的CaC2O4-DB/CTS混匀,处理180 min。处理完成后,根据GB 11914—1989[33]规定测定其COD,并计算COD去除率。结果表明,当CaC2O4-DB/CTS投加量为6 g/L,吸附180 min后,染料去除率为95.76%,COD去除率为90.33%。该吸附材料与陈锦诗等[34]研究杂化吸附CFC对EV的吸附相比,解决了材料应用于染料废水固液难分离的问题。表明CaC2O4-DB/CTS吸附剂在实际印染废水处理中具有良好的应用前景。
3. 结 论
(1) 以壳聚糖(CTS)负载草酸钙-直接枣红B(CaC2O4-DB)杂化材料,多聚磷酸钠溶液为固化剂,采用共混原位固载法,制备一种新型环保CaC2O4-DB/CTS复合多孔微球作吸附材料。通过不同的动力学模型探究CaC2O4-DB/CTS对乙基紫(EV)的吸附行为。结果表明,吸附过程更符合准二级动力学吸附;吸附过程的主要控速步骤为颗粒内扩散和染料分子与活性基之间的化学反应。
(2) 将CaC2O4-DB/CTS对EV的吸附过程进行等温线模型拟合和热力学分析。实验结果表明吸附过程符合Langmuir等温线模型,吸附方式主要为单分子层吸附。该吸附过程可自发进行,吸附能力随着温度升高而增强。
(3) CaC2O4-DB/CTS材料应用于处理EV染料废水(化学需氧量(COD)=187.64 mg·L−1)。由实验数据可得,当CaC2O4-DB/CTS投加量为6 g/L,吸附180 min后,染料去除率为95.76%,COD去除率为90.33%。CaC2O4-DB/CTS吸附剂制备成本低,在实际印染废水处理中具有良好的应用前景。
-
图 1 各种材料SEM图像:(a) 壳聚糖(CTS)材料表面;(b) CTS材料切面;(c) CaC2O4-直接枣红B(DB)/CTS材料表面;(a1) CTS材料表面局部放大图;(b1) CTS材料切面局部放大图;(c1) CaC2O4-DB/CTS材料切面;(d) CaC2O4-DB材料
Figure 1. SEM images of chitosan (CTS) ((a), (b)), CaC2O4-direct claret B (DB)/CTS (c) and CaC2O4-DB (d), area of CaC2O4-DB materials (a1), CTS materials (b1), CaC2O4-DB/CTS materials (c1)
表 1 动边界模型拟合参数
Table 1 Parameters of moving boundary model Rate controlling step
Moving boundary model Rate controlling step k R2 Liquid film diffusion 0.01217 0.9643 Intraparticle diffusion 0.00280 0.9341 Chemical reaction 0.00196 0.9319 Notes: k—Constant of rate; R2—Fitting coefficients. 表 2 CaC2O4-DB/CTS吸附EV各吸附动力学方程的参数
Table 2 Kinetics parameters of kinetic models for the adsorption of EV on CaC2O4-DB/CTS
First-order kinetic model Second-order kinetic model Elovich model qe/(mg·g−1) K1/min−1 R2 qe/(mg·g−1) K2/(g·mg−1·min−1) R2 qe/(mg·g−1) α/(g·mg −1·min−1) R2 13.22 0.0204 0.9682 32.15 0.0311 0.9995 30.63 109.57 0.9858 Notes:qe—Equilibrium adsorption capacity; qt—Adsorption capacity at time t; kl—Rate constant of the pseudo-first-order model; k2—Rate constant of the pseudo-second-order model; β—Desorption constant. 表 3 CaC2O4-DB/CTS对EV吸附颗粒内扩散模型参数
Table 3 Parameters of intra-particle kinetic model for the adsorption of EV on CaC2O4-DB/CTS
The first step >The second step >The third step >qt=1.765t1/2+14.51 >qt=0.942t1/2+19.45 >qt=0.209t1/2+28.19 kp C R2 kp C R2 kp C R2 1.765 14.51 0.9933 0.942 19.45 0.9915 0.209 28.19 0.9999 Notes:kp—Constant intra-particle diffusion rate; C—Constant of the reaction boundary layer effect. 表 4 CaC2O4-DB/CTS对EV等温吸附线参数
Table 4 Isotherm parameters for adsorption of EV on CaC2O4-DB/CTS
T/K Langmuir model Freundlich model D-R model qm/(mg·g−1) KL/(L·mg−1) R2 KF/(mg·g−1)·
(L·mg−1)1/nn R2 k/(mol2·kJ−2) R2 ε/(kJ·mol−1) 288.15 40.65 0.0768 0.9964 7.72 2.75 0.9842 0.4671 0.9429 5.17 298.15 45.25 0.0959 0.9952 8.85 2.64 0.9285 0.4046 0.9794 5.96 308.15 51.81 0.1092 0.9980 9.62 2.40 0.9458 0.3054 0.9883 7.92 Notes: T—Temperature; qm—Maximumadsorption capacity; KL —Langmuir characteristic constant; KF—Freundlich characteristic constant; n—Freundlich characteristic constant; k—Constant of adsorption energy; ε—Adsorption potential energy. 表 5 CaC2O4-DB/CTS材料吸附EV的热力学参数
Table 5 Isotherm parameters for adsorption of EV on CaC2O4-DB/CTS
C0/(mg·L−1) T/K ΔG/(kJ·mol−1) ΔH/(kJ·mol−1) ΔS/(J·(mol·K)−1) 125 288.15-308.15 −2.204 - −4.412 27.5228 0.1031 150 −1.598 - −3.393 22.5636 0.0839 175 −0.9234 - −2.810 24.5821 0.0887 Notes: C0—Initial concentration; ΔG—Gibbs free energy change; ΔH—Enthalpy change; ΔS—Entropy change. -
[1] YANG X Y, CHEN L H, LI Y, et al. Hierarchically porous materials: Synthesis strategies and structure design[J]. Che-mical Society Reviews,2017,46(2):481-558. DOI: 10.1039/C6CS00829A
[2] BHATNAGAR A, SILLANPAA M, WITEK A. Agricultural waste peels as versatile biomass for water purification-A review[J]. Chemical Engineering Journal,2015,270:244-271. DOI: 10.1016/j.cej.2015.01.135
[3] KAYAN A. Inorganic-organic hybrid materials and their adsorbent properties[J]. Advanced Composite and Hybrid Materials,2019,2:34. DOI: 10.1007/s42114-018-0073-y
[4] NF N T, KAMARUDDIN A F, WAN I. Advances in organic-inorganic hybrid sorbents for the extraction of organic and inorganic pollutants in different types of food and environmental samples[J]. Journal of Separation Science,2018,41:195-208. DOI: 10.1002/jssc.201700689
[5] PARISA M P, SEYED J P. Review on recent progress in chitosan-based hydrogels for wastewater treatment application[J]. Carbohydrate Polymers,2018,201:264-279. DOI: 10.1016/j.carbpol.2018.08.070
[6] 牛耀岚. 新型壳聚糖纤维材料的制备及其对重金属离子的吸附研究[D]. 上海: 上海交通大学, 2017. NIU Yaolan. The preparation of chitosan-based fibrous materials and research of adsorption performance for metal ions[D]. Shanghai: Shanghai Jiaotong University, 2017(in Chinese).
[7] ZHANG Q S, ZHANG T T, HE T, et al. Removal of crystal violet by clay/PNIPAm nanocomposite hydrogels with various clay contents[J]. Applied Clay Science,2014,90:1-5. DOI: 10.1016/j.clay.2014.01.003
[8] 赵丹华. CaF2-WAGGS杂化吸附材料的制备及应用研究[J]. 水处理技术, 2012, 8(8):51-54. DOI: 10.3969/j.issn.1000-3770.2012.08.014 ZHAO Danhua. Preparation of the calcium fluoride-weak acid green as hybrid absorption material and application to dye wastewater treatment[J]. Technology of Water Treatment,2012,8(8):51-54(in Chinese). DOI: 10.3969/j.issn.1000-3770.2012.08.014
[9] MOHAMMED E K, EI M N, BAHCINE B, et al. Study of removal of Congo red by local natural clay[J]. Scientific Study and Research,2016,17(3):295-307.
[10] KANNAN K P, GEORGE T S, GURU K S. Extraction, purification and characterization of chitosan from endophytic fungi isolated from medicinal plants[J]. World Journal of Science and Technology,2011,1(4):43-48.
[11] 马建青. 基于壳聚糖和石墨相氮化碳的净水材料制备及其机理研究[D]. 杭州: 浙江大学, 2018. MA Jianqing. Preparation and mechanism study of water purification materials based on chitosan and graphitic carbon nitride[D]. Hangzhou: Zhejiang University, 2018(in Chinese).
[12] MRIDUSMITA G, PRODEEP P. Enhanced adsorption of cationic dyes using sulfonic acid modified activated carbon[J]. Journal of Environmental Chemical Engineering,2017,5:3508-3517. DOI: 10.1016/j.jece.2017.07.016
[13] FAN L, LU Y, YANG L Y, et al. Fabrication of polyethylenimine-functionalized sodium alginate/cellulose nanocrystal/polyvinyl alcohol core-shell microspheres ((PVA/SA/CNC)@PEI) for diclofenac sodium adsorption[J]. Journal of Colloid and Interface Science,2019,554:48-58. DOI: 10.1016/j.jcis.2019.06.099
[14] SAYED G O. Removal of methylene blue and crystal violet from aqueous solutions by palm kernel fiber[J]. Desalination,2011,272:225-232. DOI: 10.1016/j.desal.2011.01.025
[15] 谭忠祥. 高堆积密度壳聚糖及其制备方法: 中国, ZL02110716.5[P]. 2002-8-21. TAN Zhongxiang. High bulk density chitosan and its preparation method: China, ZL02110716.5[P]. 2002-8-21(in Chinese).
[16] HUI K S, CHO C Y N, KOT S C. Removal of mixed heavy metal ions in wastewater by zeolite 4A and residual products from recycled coal fly ash[J]. Journal of Hazardous Materials,2005,127(13):89-101.
[17] SILVIA P D, FABIANO B S, APARECIDO N M, et al. Kinetic, equilibrium and thermodynamic phenomenological modeling of reactive dye adsorption onto polymeric adsorbent[J]. Chemical Engineering Journal,2017,307:466-475. DOI: 10.1016/j.cej.2016.08.104
[18] LIU C, OMER A M, OUYANG X K. Adsorptive removal of cationic methylene blue dye using carboxymethyl cellulose/k-carrageenan/activated montmorillonite composite beads: Isotherm and kinetic studies[J]. International Journal of Biological Macromolecules,2018,106:823-833. DOI: 10.1016/j.ijbiomac.2017.08.084
[19] KUMARI H J, KRISHNAMOORTHY P, ARUMUGAM T K, et al. An efficient removal of crystal violet dye from waste water by adsorption onto TLAC/Chitosan composite: A novel low-cost adsorbent[J]. International Journal of Biological Macromolecules,2017,96:324-333. DOI: 10.1016/j.ijbiomac.2016.11.077
[20] SONG X, AN J L, HE C, et al. A bioinspired strategy towards super-adsorbent hydrogel spheres via self-sacrificing micro-reactors for robust wastewater remediation[J]. Jour-nal of Materials Chemistry,2019,7:21386-21403. DOI: 10.1039/C9TA05550A
[21] HO Y S, MCKAY G. Pseudo-second order model for sorption processes[J]. Process Biochemistry,1999,34(5):451-465. DOI: 10.1016/S0032-9592(98)00112-5
[22] 万骏. 基于功能设计的水凝胶对水中磷酸盐去除研究[D]. 武汉: 华中科技大学, 2018. WAN Jun. Hydrogels based on functional design for phosphorous removal from water[D]. Wuhan: Huazhong University of Science and Technology, 2018(in Chinese).
[23] HU X, ZHANG H, SUN Z R. Adsorption of low concentration ceftazidime from aqueous solutions using impregnated activated carbon promoted by iron copper and aluminum[J]. Applied Surface Science,2017,392:332-341. DOI: 10.1016/j.apsusc.2016.09.047
[24] AHMED M J. Adsorption of quinolone, tetracycline from aqueous solutions onto multi-walled carbon nanotubes with different oxygen contents[J]. Scientific Reports,2014,4(3):4326-4332.
[25] KAUSHAL S, BADRU R, KUMAR S, et al. Efficient removal of cationic and anionic dyes from their binary mixtures by organic-inorganic hybrid material[J]. Journal of Inorganic and Organometallic Polymers and Materials,2018,28(3):968-977. DOI: 10.1007/s10904-018-0817-8
[26] INYINBOR A A, ADEKOLA F A, OLATUNJI G A. Kinetics, isotherms and thermodynamic modeling of liquid phase adsorption of Rhodamine B dye onto Raphia hookerie fruit epicarp[J]. Water Resources and Industry,2016,15:14-27. DOI: 10.1016/j.wri.2016.06.001
[27] SANGHWA O, KAWK M Y, SHIN W S. Competitive sorption of lead and cadmium onto sediments[J]. Chemical Engineering Journal,2009,152(23):376-388.
[28] SCHEUFELE F B, MODENEDS A N, BORBA C E, et al. Monolayer-multilayer adsorption phenome-nological model: Kinetics, equilibrium and thermodynamics[J]. Chemical Engineering Journal,2016,284:1328-1341. DOI: 10.1016/j.cej.2015.09.085
[29] ISAH U A, ABDULRAHEEM G, BALA S, et al. Kinetics, equilibrium and thermodynamics studies of Reactive Blue 19 dye adsorption on coconut shell based activated carbon[J]. International Biodeterioration Biodegradation,2015,102:265-273. DOI: 10.1016/j.ibiod.2015.04.006
[30] AHMAD A, MOHD-SETAPAR S H, AHMAD A, et al. Recent advances in new generation dye removal technologies: Novel search for approaches to reprocess wastewater[J]. RSC Advances,2015,5(39):30801-30818. DOI: 10.1039/C4RA16959J
[31] OEPEN B V, KORDEL W, KLEIN W. Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD-Guideline 106[J]. Chemosphere,1991,22(3-4):285-304. DOI: 10.1016/0045-6535(91)90318-8
[32] NOLLET H, ROELS M, LUTGEN P, et al. Removal of PCBs from wastewater using fly ash[J]. Chemosphere, 2003, 53: 655-665.
[33] 国家环境保护局. 水质化学需氧量的测定−重铬酸盐法: GB/T 11914—1989[S]. 北京: 中国标准出版社, 1989. National Environmental Protection Agency. Water quality-Determination of the chemical oxygen demand-Dichromate method: GB/T 11914—1989[S]. Beijing: China Standards Press, 1989(in Chinese).
[34] 陈锦诗, 孙诗乐, 黄文海, 等. CaF2-CR杂化吸附材料对乙基紫的吸附性能研究[J]. 化学试剂, 2018, 40(10):937-942, 970. CHEN Jinshi, SUN Shile, HUANG Wenhai, et al. Adsorption of ethylene violet on hybrid adsorption material of CaF2-CR[J]. Chemical Reagents,2018,40(10):937-942, 970(in Chinese).
-
期刊类型引用(5)
1. 陈作义,陈考昌,李华辉,柯永霞,柳晓俊,赵丹华. CA/COSBC复合凝胶微球的制备及其对Pb(Ⅱ)的吸附性能. 精细化工. 2024(11): 2423-2432 .  百度学术
百度学术
2. 冯芳芳,刘志浩,陈作义,贾屹海,赵丹华. 改性膨胀石墨的制备及其对Cr(Ⅵ)的吸附性能研究. 化学与生物工程. 2023(06): 51-57 .  百度学术
百度学术
3. 刘松林,王仲民,钱熹,王童,冉兆晋,黄志民,吴晨曦,李桂银. 磁性氮掺杂石墨烯改性柿单宁复合材料对四环素的吸附行为. 复合材料学报. 2023(07): 4048-4059 .  本站查看
本站查看
4. 和芹,舒世立. 磁性海藻酸钠三互穿网络水凝胶对亚甲基蓝的吸附. 化学通报. 2023(12): 1523-1529 .  百度学术
百度学术
5. 詹李明,李建华,黄雅雯,蓝森美,冯芳芳,陈作义,柳晓俊,赵丹华. 不同密度海藻酸钙复合微球的制备及其对Cu(Ⅱ)吸附行为的研究. 化学与生物工程. 2022(08): 25-31 .  百度学术
百度学术
其他类型引用(0)
-




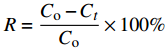
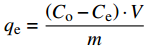

 下载:
下载: