Bacteriostatic study of Kanamycin synergistic Cu2O/CuO composites targeting the bacterial cell wall
-
摘要:
随着耐药菌的出现,以传统抗生素为代表的抑菌剂药用价值逐步降低,因此,亟需开发新型抗菌剂来解决细菌耐药和提升抗生素药效问题。本文用[Cu(NO3)2·3H2O]和N2H4·H2O制备纳米氧化亚铜(Cu2O/CuO),最后通过“浸渍法”将硫酸卡那霉素(Kanamycin)负载到纳米氧化亚铜上得到卡那霉素协同Cu2O/CuO (Cu2O/CuO-Kanamycin)纳米复合材料,并对Cu2O/CuO-Kanamycin复合材料的形貌结构、元素含量和键合方式等进行系统表征。以模型菌革兰氏阴性菌大肠杆菌(E. coli)、革兰氏阳性菌金黄色葡萄球菌 (S. aureus)和耐卡那霉素-沙门氏菌(D-Salm)为对象研究Cu2O/CuO-Kanamycin复合材料的抑菌效率及其作用机制。表征结果显示:制备的实心立方体Cu2O/CuO结构,因与空气有较小的接触面积而相对稳定,可与Kanamycin的—OH基团相互吸引并发生配位键合。抑菌活性表明:Cu2O/CuO-Kanamycin复合物在50 µg/mL浓度下,20 min内对E. coli、S. aureus和D-Salm的抑菌率超过99%,其中对E. coli敏感性更高。抑菌机制证明:复合材料主要通过破坏细菌细胞壁的结构而使细菌死亡。此研究不仅可提升传统抗生素的药用价值,且对耐药菌的抗菌性能显著提高,同时为医疗材料和环境卫生等领域提供广泛的科学依据。
Abstract:With the emergence of drug-resistant bacteria, the medical value of bacteriostatic agents represented by traditional antibiotics is gradually decreasing, so there is an urgent need to develop novel antimicrobials to solve the problems of bacterial drug resistance and improve the efficacy of antibiotics. In this paper, we prepared cuprous oxide nanoparticles (Cu2O/CuO) from [Cu(NO3)2·3H2O] and N2H4·H2O, and then loaded Kanamycin sulfate onto the cuprous oxide nanoparticles by the impregnation method. Finally, Kanamycin sulfate (Kanamycin) was loaded onto the cuprous oxide nanocomposites by the "impregnation method" to obtain Kanamycin-coordinated Cu2O/CuO (Cu2O/CuO-Kanamycin) nanocomposites, and the morphological structure, elemental content and bonding mode of the Cu2O/CuO-Kanamycin composites were systematically characterised. Gram-negative Escherichia coli (E. coli), Gram-positive Staphylococcus aureus (S. aureus) and Kanamycin-resistant Salmonella (D-Salm) were used as model organisms to study the bacterial inhibition efficiency of Cu2O/CuO-Kanamycin composites and their mechanism of action. The characterisation results showed that the prepared solid cubic Cu2O/CuO structure, which is relatively stable due to the small contact area with air, can be mutually attracted and ligated with the —OH group of Kanamycin. The inhibitory activities showed that the Cu2O/CuO Kanamycin complexes exhibited more than 99% inhibition of E. coli, S. aureus and D-Salm within 20 min at a concentration of 50 µg/mL, with a higher susceptibility to E. coli. The mechanism of bacterial inhibition showed that the composites killed the bacteria mainly by disrupting the structure of the bacterial cell wall. This study not only enhances the medicinal value of traditional antibiotics and significantly improves the antimicrobial performance against drug-resistant bacteria, but also provides a broad scientific basis for the fields of medical materials and environmental hygiene.
-
由于高发病率和死亡率,细菌感染已成为严重的全球卫生健康问题[1]。在过去的几十年里,抗生素被广泛用于由细菌感染引起的临床疾病。硫酸卡那霉素是一种氨基糖苷类广谱抗生素,作为有机抑菌剂,它主要对革兰阴性菌如大肠杆菌、结核杆菌及革兰阳性菌、支原体、衣原体、病毒等均具有良好的抗菌作用。但由于硫酸卡那霉素的泛滥应用及生存环境的变化等原因,导致对微生物中小片段的耐药性基因表达水平提高,大量耐药菌产生,致使硫酸卡那霉素的药用价值不断下降,这将对我国医药行业发展带来严重损失[2-3]。因此,迫切需要开发出新型高效抗菌剂来应对耐药和提升抗生素药效问题[4]。
无机纳米材料中,氧化亚铜具有很好的抑菌性能。因其高效、广谱和经济的特性,它已被大规模应用于海洋防污、农药杀菌等领域。同时,铜的d轨道为满电子,易成为供电子基,可与生物体内含氨基、羟基、巯基等官能团的氨基酸配位,为生物体内正常的新陈代谢提供活性位点和酶促中心,进而成为真核生物的必需微量元素[5]。氨基糖苷类抗生素如庆大霉素、卡那霉素和阿米卡星[6]中氨基和羟基基团不仅提供了大量的氢键,且铜与胺可通过羟基(质子化或去质子化)的螯合配位作用增强其稳定性[7]。Manning等[8]在铜-聚乙二醇-阿米卡星复合物抗结核杆菌的结构测定和细胞系研究中发现,其复合物在溶液中比单独的抗生素或铜-抗生素复合物具有更好的抑菌性能。其原理是Cu2+具有结合胺的选择性,增加了络合物的电荷和水溶性,并且Cu2+是结核杆菌的必需微量元素,因此复合物可以被结核杆菌很好地吸收,提高其抑菌活性。Varaprasad等[9]研究了CuO-Curcumin纳米材料的抑菌性能,证明CuO-Curcumin比商业抗生素阿莫西林具有更好的抑菌活性。铜离子与Curcumin的—OH基团配位形成的配体/金属配位络合物复合材料不仅增加了Curcumin的生物利用度,也显著提高其抗菌性能。以上研究均表明,抗生素纳米复合材料比单独的无机抑菌剂或抗生素具有更高的抗菌活性。但目前的研究主要集中在单一纳米材料与少数抗生素产生协同作用,对其具体抑菌机制探究较少。
基于此,用[Cu(NO3)2·3H2O]和N2H4·H2O制备纳米氧化亚铜(Cu2O/CuO),通过“浸渍法”将硫酸卡那霉素(Kanamycin)负载到纳米氧化亚铜上得到Cu2O/CuO-Kanamycin纳米复合材料。采用透射电子显微镜(TEM,JEM-2100 Plus,日本)、X射线衍射(XRD,XRDynamic 500,美国)、X射线光电子能谱(XPS,Axis Nova,英国)、傅里叶变换红外光谱仪(FTIR,Nicolet 6700,美国)、紫外分光光度计(UV-vis,BioDrop-Duo,英国) 表征复合材料的微观形貌、组成成分、元素含量和键合方式。选取模型菌革兰氏阴性菌大肠杆菌(E. coli)、革兰氏阳性菌金黄色葡萄球菌 (S. aureus)和耐卡那霉素-沙门氏菌(D-Salm)为对象研究该抑菌剂的协同抑菌性能和抑菌机制。
1. 实验材料与方法
1.1 原材料
硫酸卡那霉素(98%,Kanamycin sulfate,合肥博美生物公司)、三水硝酸铜(Cu(NO3)2·3H2O,99%,南京化学试剂股份有限公司)、水合肼(N2H4,80%,山东特纳亚索化学技术有限公司)、聚乙烯吡咯烷酮(PVP,99%,湖北魏氏化学试剂股份有限公司)、氢氧化钠(NaOH,96%,山东诚泰化工有限公司)、磷酸氢钠(Na2HPO4,99%,山东萍聚生物科技有限公司)、碘化丙啶(PI,上海麦克林生化科技有限公司)、磷酸氢二钠(Na2HPO4,99%,焦作市信德化工有限公司)、无水乙醇(CH3CH2OH,AR,深圳市北化精细化学品有限公司)、氯化钠(NaCl,AR,湖北省华大精细化工有限公司)、LB固体培养基(酵母浸粉、琼脂和胰蛋白胨,均由天津市大茂化学试剂场提供);大肠杆菌(ATCC8739)、金黄色葡萄球菌(ATCC9144)、耐药菌沙门氏菌(ATCC14028),均由天津益元利康生物科技有限公司提供。
1.2 材料制备
1.2.1 Cu2O/CuO的制备
准确称取
0.4832 g的[Cu(NO3)2·3H2O]和2 g的PVP加入锥形瓶中,加入80 mL去离子水(dH2O),经超声处理后向溶液中加入0.4 g NaOH并开始磁力搅拌。在10 min后,缓慢滴加以20 mL蒸馏水溶解的50 μL N2H4·H2O,继续搅拌反应30 min后以8000 r/min的速度离心处理溶液,使用dH2O洗涤4次,无水乙醇洗涤1次,最后将溶液置于65℃的烘箱(101-5B,上海昕仪仪器仪表有限公司)中干燥过夜,制得砖红色固体。1.2.2 Cu2O/CuO-Kanamycin的制备
将30 mg卡那霉素(Kanamycin)溶解在30 mL的dH2O中,形成溶液。接着,将100 mg制备好的Cu2O/CuO粉末加入到30 mL 的卡那霉素溶液中。为了确保固体粉末在溶液中均匀分散,使用超声处理30 min。处理完毕后,将混合液密封,并置于避光环境中静置3~4 h。之后,通过离心机(H1850,湖南湘仪实验室仪器开发有限公司 )以
8000 r/min的速度离心15 min,分离出沉淀物。最后,将沉淀物放入真空干燥箱(DZF-6020-T,上海丙林电子科技有限公司)中进行干燥处理,得到最终的蓝黑色固体产物。1.3 Cu2O/CuO-Kanamycin的抗菌活性测定
菌种活化:分别吸取10 μL 3种细菌菌种到5 mL液体培养液(酵母浸粉、NaCl、胰蛋白胨和无菌蒸馏水)中,恒温振荡摇床 24 h,以促进菌种快速生长至指数期,分别吸取上述培养液,稀释至菌落数为5×105 CFU (Colony forming units)/mL[10-11],以备后续实验使用。所有实验材料均在120℃高压灭菌锅(LDZF-75L,上海申安医疗器械厂)中高温灭菌,整个操作过程都在无菌环境中进行,每组实验均进行3次平行操作。
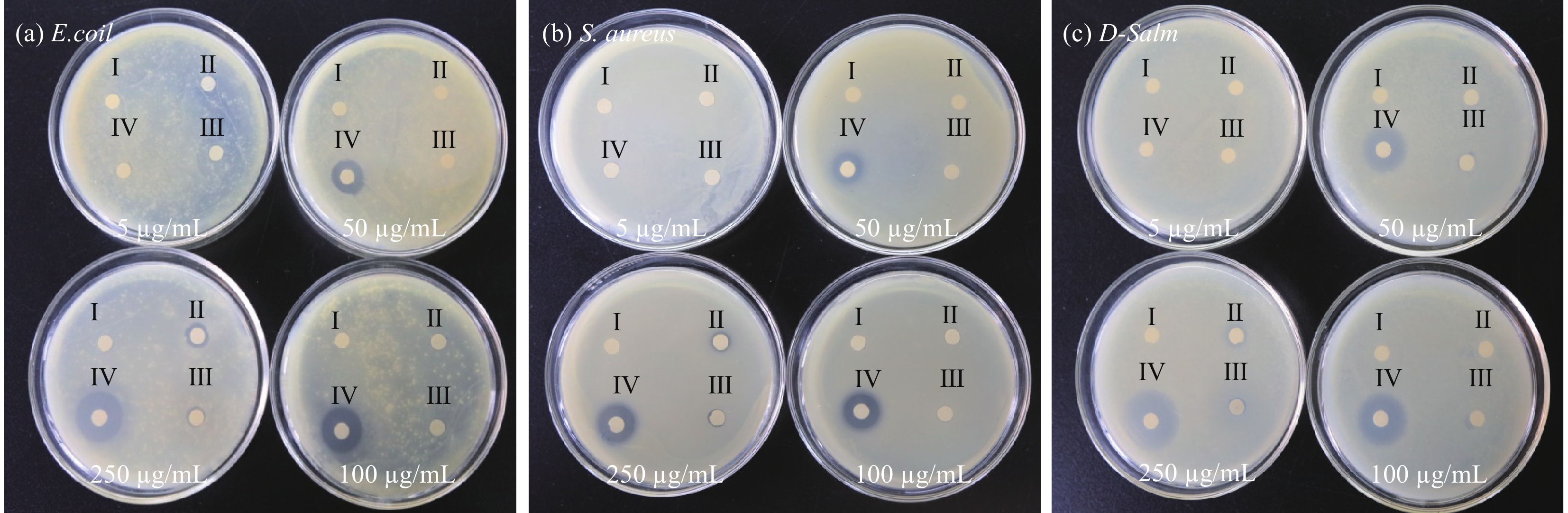
滤纸片扩散实验:无菌蒸馏水作为对照组,Kanamycin、Cu2O/CuO-Kanamycin和Cu2O/CuO分别被溶解在dH2O中,配制成5、50、100和250 μg/mL的溶液。将3种菌悬液稀释至5×105 CFU/mL,均匀涂布于固体培养基表面。随后,将含有7 μL不同的材料的溶液分别滴加至无菌滤纸片上,37℃恒温培养12 h以观察结果。
菌落计数实验。纯菌悬液作为对照组,将复合材料与5×105 CFU/mL的3种细菌菌悬液混合,分别在5、10、20、40和80 min时,取10 μL上清液涂布均匀于LB固体培养基上,孵化12 h,并记录菌落数。
计算抑菌效率如下式所示:
Y=X0−XX0×100% (1) 其中:Y为抑菌效率;X0为对照组中菌落数;X为不同时间内测得的菌落生长数。
最小抑菌浓度(MIC):细菌经活化后,用超纯水稀释成5×105 CFU/mL。取10 μL菌液加入5 mL含不同浓度Cu2O/CuO-Kanamycin复合材料的混合培养基及不加入复合材料的液体培养基中,将不加Cu2O/CuO-Kanamycin复合材料的液体培养基作为空白对照组,在恒温(37℃)摇床内培养12 h。测定各试管菌群浓度(CFU/mL)制表[12-13]。
1.4 抑菌机制研究
细胞壁电位分析:将活化后的细菌稀释至3.5×108 CFU/mL,随后菌悬液与复合材料混合至200 µg/mL,培养5 min和40 min后离心5 min (
5000 r/min)去除Cu2O/CuO-Kanamycin复合材料,测定菌液的Zeta电位值[14]。每组实验重复3次,以分析数据。PI染色法:将测试菌用无菌水稀释至1.5×108 CFU/mL。设立纯菌悬浊液为对照组,另将400 μL测试菌与6 μL (10 mg/mL)复合材料混合,作为实验组。实验组和对照组在37℃下均进行12 h的恒温振荡培养。经离心(
5000 r/min)处理后,取300 μL上清液,加入15 μL PI染色剂,在无光环境下染色8 min。随后,离心6 min (5000 r/min),用磷酸缓冲液(PBS)洗涤3次,最后使用IX73荧光显微镜(奥林巴斯株式会社)检测。细胞质物质泄露测定:将活化处理后的E. coli、S. aureus和D-Salm 3种测试菌稀释至1.5×108 CFU/mL,从每种测试菌中分别吸取3 mL的菌液,将其与Cu2O/CuO-Kanamycin纳米复合材料混合,确保复合材料在混合液中的浓度为200 μg/mL,形成实验组样本。同时,另取3 mL未经处理的纯菌液作为对照组。随后,将配制好的实验组和对照组样本在25℃的恒温条件下振荡24 h。完成振荡后,对样本进行离心处理,以
15000 r/min的速度离心10 min。离心结束后,使用0.22 μm的水式过滤器对上清液进行过滤。采用紫外可见分光光度计(UV-6100S型,上海元析仪器有限公司)测定过滤后液体的紫外光谱吸收值。为确保数据的准确性,该步骤需平行进行3次,并对所得数据进行分析[15]。2. 结果与分析
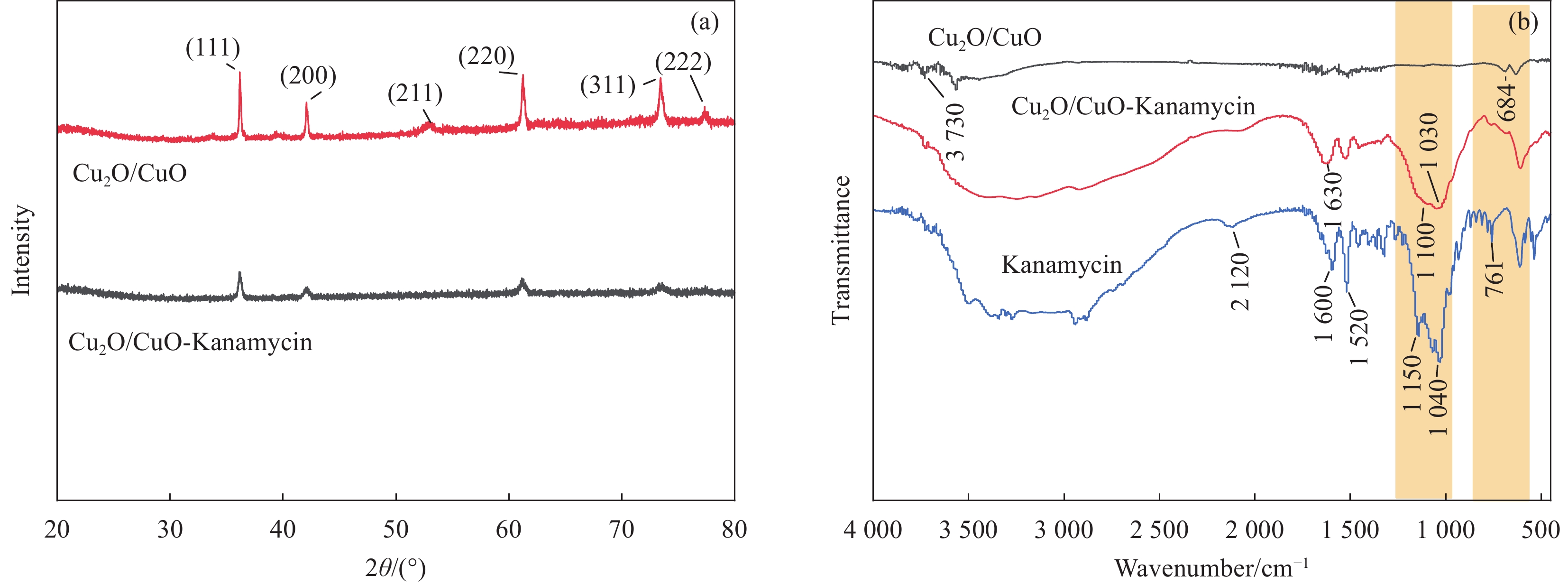
本文采用化学还原法,使用 N2H4·H2O作为还原剂,将Cu2+还原为Cu+,成功制备出纳米Cu2O/CuO。之后,通过与市售抗生素硫酸卡那霉素(Kanamycin)形成配位键,得到Cu2O/CuO-Kanamycin复合物,制备过程详见图1。图2为具有良好分散性和较光滑表面的实心立方体Cu2O结构,平均粒径为(403.89±45) nm。Cu2O/CuO-Kanamycin复合材料的XRD结果如图3(a)所示,在36.4°、42.4°、52.5°、61.3°、73.4°和77.4°处的6个特征峰与Cu2O(JCPDS Card No. 05-0667) [16]的(111)、(200)、(211)、(220)、(311)和(222)晶面相对应。值得注意的是,Cu2O/CuO-Kanamycin复合材料的XRD衍射峰虽然与Cu2O的衍射峰相吻合,但峰强度有所减弱且峰位向低角度偏移,其原因可能是Cu2O/CuO与Kanamycin之间发生了某种配位作用。图3(b)为Cu2O/CuO、Kanamycin和Cu2O/CuO-Kanamycin的FTIR光谱图。在Kanamycin的红外光谱分析中,
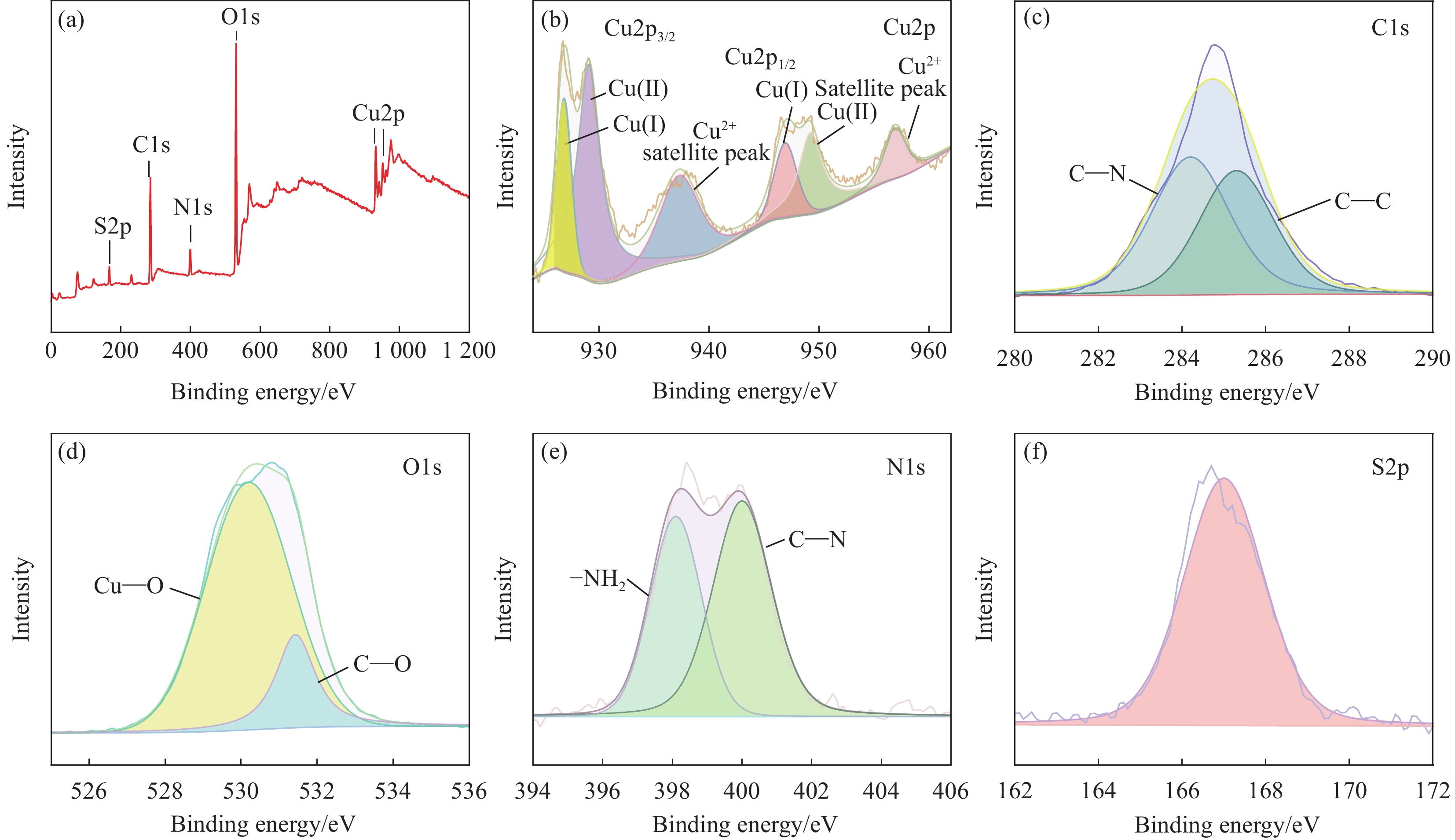
3350 ~3270 cm−1、2940 cm−1、1650 ~1520 cm−1、1150 ~1040 cm−1处的伸缩振动吸收峰分别对应卡那霉素中O—H、C—H、N—H和C—O—C键[17-19]。通过与Cu2O/CuO的傅里叶变换红外光谱(FTIR)进行比较,发现Cu2O/CuO-Kanamycin复合物在1630 cm−1处的吸收峰出现了位移,且在1100 ~1030 cm−1范围内出现了新的吸收峰。这些变化可能归因于Kanamycin中的N—H、C—O—C基团与Cu2O/CuO之间的配位作用。因此,FTIR光谱分析进一步证实了Kanamycin与Cu2O/CuO之间存在配位作用。图S1为Cu2O/CuO负载Kanamycin的UV-vis光谱。620 nm左右观察到材料的吸收边界,与文献[17]中Cu2O的吸收边界一致,这进一步证明Cu2O被成功制备。Kanamycin在289 nm处具有一个强吸收峰,与上清液(Cu2O/CuO与Kanamycin浸渍离心后)在289 nm的吸收峰比对可知,Kanamycin在Cu2O/CuO表面的负载率约为10.9%。用XPS研究复合材料的元素成分和状态,图4(a)为纳米复合材料的XPS总谱。图4(b)中,952.5和 932.6 eV为Cu2O中Cu2p1/2和Cu2p3/2的结合能[20]。而933.4和953.2 eV对应Cu2+ Cu2p3/2和Cu2p1/2的结合能[21-23]。如图4(c)所示,C1s光谱被分解为C—C (284.6 eV)和C—N (286.0 eV)与文献[24]报道一致。在图4(e)中XPS N1s光谱被分解为—NH2 (398.3 eV)和C—N (399.1 eV)[25-26]。图4(d)显示,Cu2O/CuO-Kanamycin复合物中—C—O的结合能为531.2 eV,较先前研究[27]报道的531.7 eV低0.5 eV。这可能归因于Cu2O颗粒与Kanamycin的—OH基团形成络合物,进而影响—C—O中氧原子的结合能。
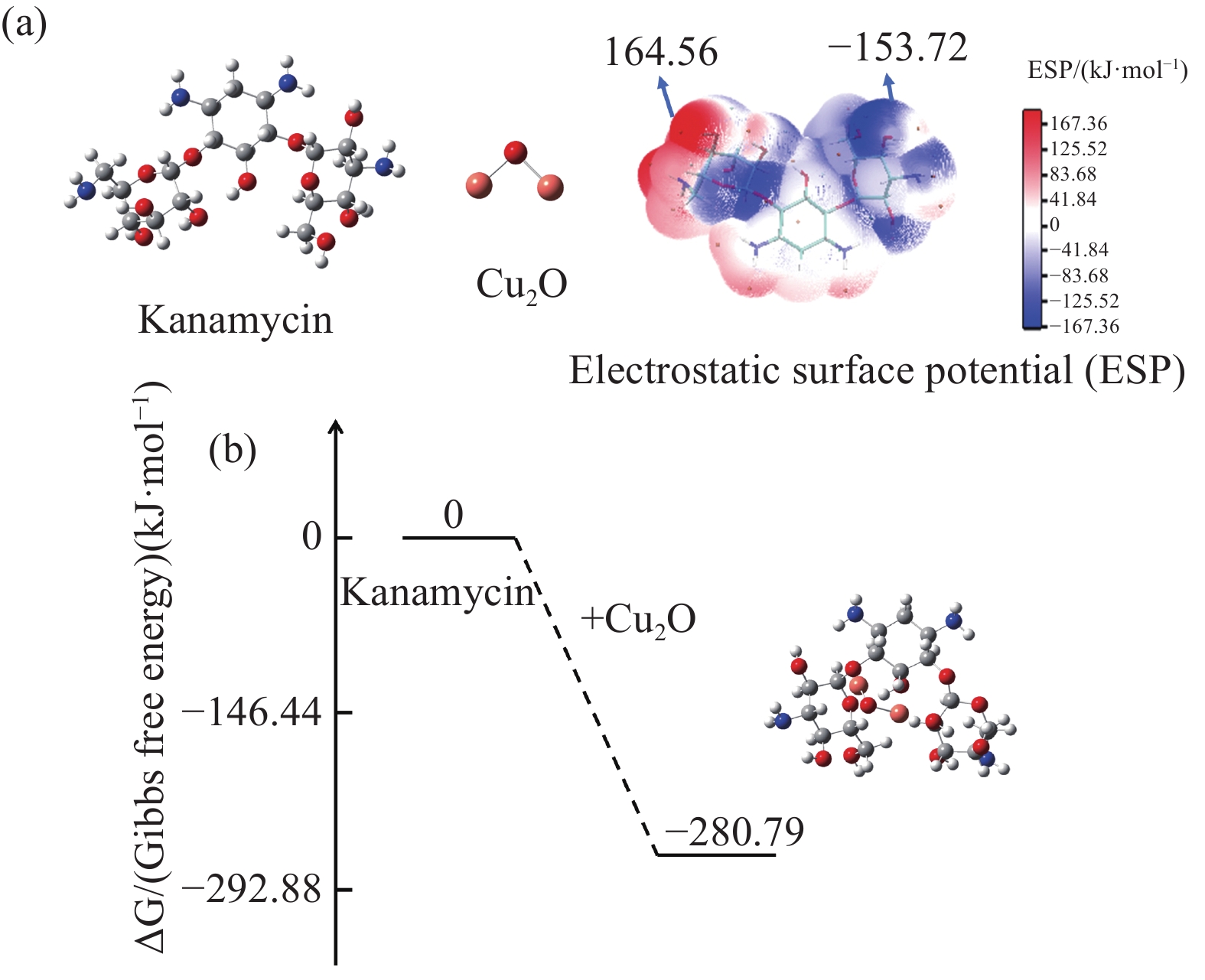
通过对图5(a)中Kanamycin的表面静电势(ESP)数据进行详细分析,在其6-氨基-6-脱氧-D-葡萄糖环—OH基团上,表面静电势达到了较高的164.56 kJ/mol。这一高值说明了该区域氢原子的酸性相对较强,属于易失去氢原子并产生氧负离子的缺电子区域。相比之下,3-氨基-3-脱氧-α-D-葡萄糖环—OH基团周围的表面静电势较低,具体值为–153.72 kJ/mol。这一负值表明该区域的—OH基团部分拥有孤对电子,形成了一个富电子区域。由于这种电子分布特性,这个区域更可能受到Cu2O颗粒的吸引,从而发生吸附反应。进一步地,图5(b)中的数据提供了有力的证据:Cu2O颗粒与Kanamycin中的—OH基团形成的复合物具有−280.79 kJ/mol的结合能。这一负值且相对较大的结合能值表明,Cu2O与Kanamycin之间可以形成稳定的复合物。这一结论与之前的红外光谱分析结果相吻合,共同证实了Cu2O与Kanamycin之间确实存在配位作用。
2.1 卡那霉素协同Cu2O/CuO复合材料的抑菌活性
采用滤纸片扩散、菌落计数法和最小抑菌浓度(MIC)全面分析Cu2O/CuO-Kanamycin纳米复合材料的抑菌性能。滤纸片扩散结果如图S2所示,以蒸馏水(Ⅰ)为空白对照组,(Ⅱ)、 (Ⅲ) 和(Ⅳ)依次为Kanamycin、Cu2O/CuO和Cu2O/CuO-Kanamycin。材料浓度为5 µg/mL时,Cu2O/CuO和Kanamycin均未展现出明显的抑菌效果。然而,随着浓度的增加, Cu2O/CuO-Kanamycin的抑菌效果明显优于同浓度的Cu2O/CuO和Kanamycin。分析结果如图6(a)~图6(c)所示,在50 µg/mL的浓度下,复合材料抑菌效率提升最快,即此浓度下抑菌效果最好。与单一Cu2O/CuO和Kanamycin相比,复合材料的抑菌活性分别提高了(2.57±0.02)和(2.25±0.01)倍(E. coli),(2.28±0.01)和(2.0±0.05)倍(S. aureus),(2.78±0.06)和(2.44±0.01)倍(D-Salm)。菌落计数法结果如图7(a)~图7(c)所示,从图中可以明显看出,在混合20 min后,3种测试菌的菌落数几乎降至0。图7(d)、图7(e)进一步表明了50 µg/mL Cu2O/CuO-Kanamycin复合材料对3种试验细菌的抗菌效果显著,其中对大肠杆菌 (E. coli)仅需10 min,抗菌率便能迅速超过99%,显示出高效的抗菌活性;对于金黄色葡萄球菌(S. aureus)和耐卡那霉素-沙门氏菌(D-Salm),经过20 min的处理,抗菌率亦能达到99%以上。最小抑菌浓度(MIC)实验结果如图S3所示,其中Ⅰ为不加材料的空白对照组。表1显示Cu2O/CuO-Kanamycin复合材料对E. coli的MIC值为30 µg/mL,对S. aureus和D-Salm的MIC值为40 µg/mL。综上,复合材料对3种模型菌均具有较高的抑菌活性,且对E. coli的抑菌活性明显高于S. aureus和D-Salm。
![]() 图 6 Kanamycin、Cu2O/CuO和Cu2O/CuO-Kanamycin复合材料对大肠杆菌(E. coli) (a)、金黄色葡萄球菌(S. aureus) (b)和耐卡那霉素-沙门氏菌(D-Salm) (c)的抑菌圈直径曲线Figure 6. Inhibition diameter profiles of Kanamycin, Cu2O/CuO and Cu2O/CuO-Kanamycin composites against Escherichia coli (E. coli) (a), Staphylococcus aureus (S. aureus) (b) and Kanamycin-resistant D-Salmonella (D-Salm) (c)
图 6 Kanamycin、Cu2O/CuO和Cu2O/CuO-Kanamycin复合材料对大肠杆菌(E. coli) (a)、金黄色葡萄球菌(S. aureus) (b)和耐卡那霉素-沙门氏菌(D-Salm) (c)的抑菌圈直径曲线Figure 6. Inhibition diameter profiles of Kanamycin, Cu2O/CuO and Cu2O/CuO-Kanamycin composites against Escherichia coli (E. coli) (a), Staphylococcus aureus (S. aureus) (b) and Kanamycin-resistant D-Salmonella (D-Salm) (c)![]() 图 7 Cu2O/CuO-Kanamycin复合材料对大肠杆菌(a)、金黄色葡萄球菌(b)和耐卡那霉素-沙门氏菌(c)的菌落计数结果;Cu2O/CuO-Kanamycin复合材料在不同时间对大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的菌落数(d)和抑菌率(e)Figure 7. Results of colony counting for Cu2O/CuO-Kanamycin composites against E. coli (a), S. aureus (b) and Kanamycin-resistant D-Salm (c); Number of colonies (d) and inhibition rate (e) of Cu2O/CuO-Kanamycin composites against E. coli, S. aureus and Kanamycin-resistant D-Salm at various times表 1 Cu2O/CuO-Kanamycin复合材料对大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的最小抑菌浓度(MIC)值 (单位:105 CFU/mL)Table 1. Minimal inhibit concentration (MIC) values of Cu2O/CuO-Kanamycin composites against E. coli, S. aureus and D-Salm (Unit: 105 CFU/mL)
图 7 Cu2O/CuO-Kanamycin复合材料对大肠杆菌(a)、金黄色葡萄球菌(b)和耐卡那霉素-沙门氏菌(c)的菌落计数结果;Cu2O/CuO-Kanamycin复合材料在不同时间对大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的菌落数(d)和抑菌率(e)Figure 7. Results of colony counting for Cu2O/CuO-Kanamycin composites against E. coli (a), S. aureus (b) and Kanamycin-resistant D-Salm (c); Number of colonies (d) and inhibition rate (e) of Cu2O/CuO-Kanamycin composites against E. coli, S. aureus and Kanamycin-resistant D-Salm at various times表 1 Cu2O/CuO-Kanamycin复合材料对大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的最小抑菌浓度(MIC)值 (单位:105 CFU/mL)Table 1. Minimal inhibit concentration (MIC) values of Cu2O/CuO-Kanamycin composites against E. coli, S. aureus and D-Salm (Unit: 105 CFU/mL)Beta-bacteria Cu2O/CuO-Kanamycin composite material/(µg·mL–1 ) 0 10 20 30 40 50 60 70 E. coli 7.44 6.17 3.81 1.11 0.21 0.21 0.19 0.17 S. aureus 5.31 3.15 2.37 2.23 0.18 0.18 0.15 0.14 D-Salm 6.89 5.41 3.78 2.14 0.23 0.18 0.15 0.13 2.2 抑菌机制的研究
通过细胞壁电位、细胞质物质泄露和碘化丙啶(PI)染色的实验方法探究Cu2O/CuO-Kanamycin复合材料的抑菌机制。细胞壁电位结果如图8(a)所示,纯菌大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的电位值分别为−15.77 mV、−14.87 mV和−14.95 mV。当复合材料与这3种测试菌作用5 min后,测得的表面电位值分别为−11.66 mV、−11.60 mV和−12.53 mV;而在作用40 min后,表面电位则分别为−4.92 mV、−5.68 mV和−6.08 mV。对比实验组和对照组的数据,可以发现3种测试菌细胞膜表面的Zeta电位值在实验组中均向正向移动。这种变化可能是由于复合材料和细菌相互作用时,Cu+和Cu2+离子的释放,它们与细菌细胞壁表面的—OH、—NH2和—COOH等活性基团[28]发生作用,进而破坏细菌细胞壁的结构,导致电位值的上升。细胞质物质的释放量可通过UV-vis在260 nm处的吸光度进行监测。图8(b)~图8(d)表明未加入纳米复合材料时细胞内的内容物释放量较少。而经纳米复合材料处理细菌后,E. coli吸光度增加0.45, S. aureus吸光度增加0.43和D-Salm吸光度增加0.35,这一变化表明纳米复合材料穿刺细菌细胞壁,引起细菌内溶物大量外泄(如蛋白质、核酸和其他生物分子),细菌将失去维持其正常生命活动的能力,从而最终导致死亡。PI能够渗透受损细胞的细胞膜,进入细胞内部与DNA结合并发出红色荧光[29](红色斑点的数量代表了死亡菌的数量)。实验结果如图9所示,我们分别设置了实验组(以150 μg/mL复合材料作用的E. coli、S. aureus和D-Salm,如图9(d)~图9(f)和对应的空白对照组(图9(a)~图9(c))。在对照组中,红色斑点数量较少,表明死菌数量不多。在实验组中,红色斑点显著增多,这充分说明了复合材料能够破坏细菌细胞壁结构,损伤细菌的DNA,导致DNA断裂或突变,从而促进细菌死亡。
![]() 图 9 大肠杆菌、金黄色葡萄球菌和耐药卡那霉素-沙门氏菌的纯菌((a)~(c))及加入Cu2O/CuO-Kanamycin纳米复合材料处理后对应的碘化丙啶(PI)染色结果图((d)~(f))Figure 9. Plots of pure bacteria of E. coli, S. aureus and D-Salm ((a)-(c)), and the corresponding results of propidium iodide (PI) staining after treatment with addition of Cu2O/CuO-Kanamycin nanocomposites ((d)-(f))
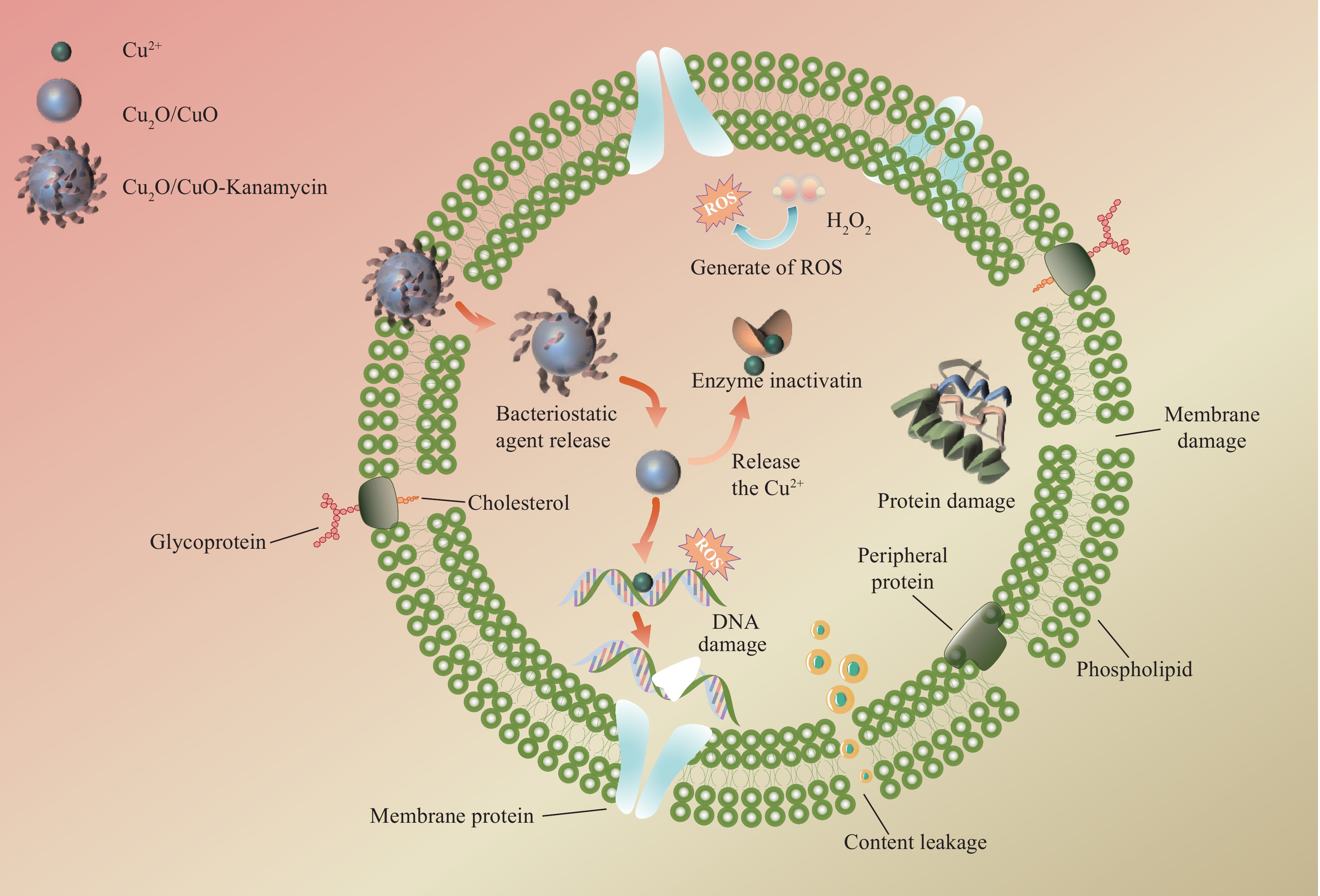
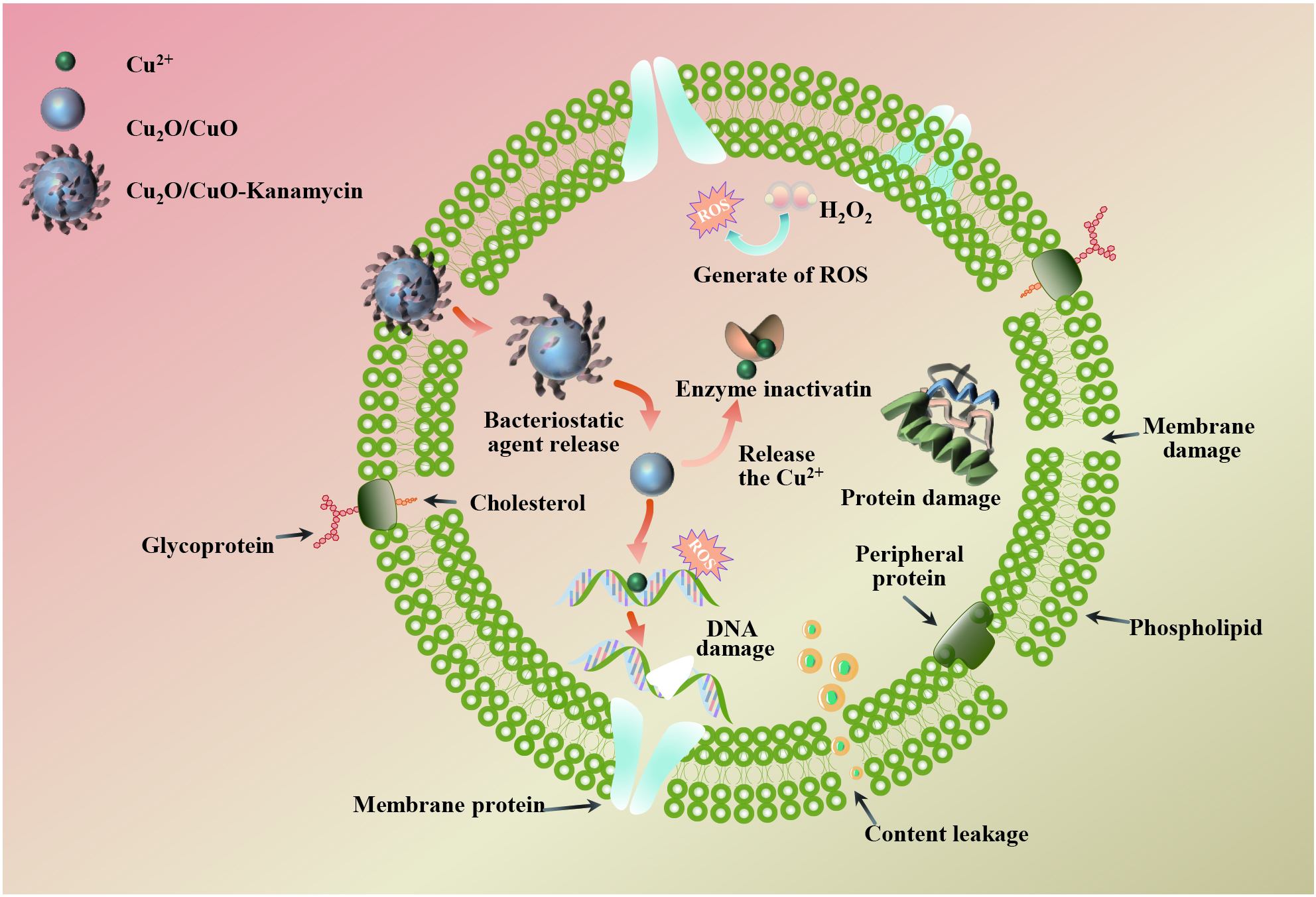
图 9 大肠杆菌、金黄色葡萄球菌和耐药卡那霉素-沙门氏菌的纯菌((a)~(c))及加入Cu2O/CuO-Kanamycin纳米复合材料处理后对应的碘化丙啶(PI)染色结果图((d)~(f))Figure 9. Plots of pure bacteria of E. coli, S. aureus and D-Salm ((a)-(c)), and the corresponding results of propidium iodide (PI) staining after treatment with addition of Cu2O/CuO-Kanamycin nanocomposites ((d)-(f))Cu2O/CuO-Kanamycin纳米复合材料分散在介质中时,Cu2O可缓释出Cu+,Cu+在空气中失电子变成Cu2+,由于细菌细胞壁中含有大量的磷脂双分子层和离子通道蛋白,表面包含大量PO43−、OH−和COO−,因此可与带正电荷的Cu2+和未反应的Cu+结合,改变细菌细胞壁二级结构,使其破裂,进而进入细胞内部与酶等蛋白质作用,导致酶变性失活,杀灭细菌。革兰氏阴性菌的细胞壁较薄,外层有一个外膜,而内部是一个较薄的肽聚糖层,中间夹有一个脂多糖层。相比之下,革兰氏阳性菌具有较厚的细胞壁,主要由肽聚糖构成,没有外膜和脂多糖层[30]。这种结构差异使铜离子更容易穿透革兰氏阴性菌的细胞壁,达到其细胞内部,从而对其显示出较高的抑菌效果。以上分析与细胞壁电位、PI 染色及细胞质内溶物质外泄测试相符。Kanamycin协同Cu2O/CuO复合材料能在溶液中释放Cu+和Cu2+,破坏细胞壁和细胞膜后,Kanamycin中的羟基可以有效地靶向细胞内细菌,干扰其核糖体功能(通过与rRNA 16S亚基上的A位点区域结合)来影响其抗菌活性,导致蛋白质生物合成的中断[31],最终细胞死亡[32](图10)。Kanamycin因其膜穿透效率低和对药物外排转运蛋白的敏感性而不能有效地在细胞内积累,导致Kanamycin对细胞内细菌的治疗价值受到严重限制[33-34]。将Cu2O/CuO和Kanamycin协同抑菌后不仅增加了Kanamycin的治疗价值,并且比单独的Cu2O/CuO和Kanamycin更有效地清除细胞内病原体。
3. 结 论
(1)以N2H4·H2O为还原剂,用[Cu(NO3)2·3H2O]合成Cu2O/CuO,通过“浸渍法”制备了Kanamycin协同Cu2O/CuO复合材料。表征结果显示Cu2O/CuO为单分散的立方体结构,粒径约为(403.89±45) nm,Kanamycin中的N—H、C—O—C、C—OH可与Cu2O/CuO发生配位作用。
(2)抑菌性能效率表明,与单一Cu2O/CuO和Kanamycin相比,复合材料的抑菌效率分别提高了(2.57±0.02)和(2.25±0.01)倍(E. coli);(2.28±0.01)和(2.0±0.05)倍(S. aureus);(2.78±0.06)和(2.44±0.01)倍(D-Salm)。50 µg/mL的复合材料在20 min时对3种测试菌的抑菌率均达到99%以上,最小抑菌浓度(MIC)值依次为30、40和40 µg/mL。实验结果说明,Kanamycin协同Cu2O/CuO复合材料比单独的Kanamycin和Cu2O/CuO具有更好的抑菌性能,且该材料对革兰氏阴性菌E. coli更敏感。
(3)抑菌机制揭示Kanamycin协同Cu2O/CuO通过释放Cu+和Cu2+附着在细菌细胞壁上,破坏细胞壁,Kanamycin靶向定位,可能影响细菌细胞中的多个靶点,包括酶、膜和DNA分子,最终致使细胞死亡。
综上所述,Kanamycin协同Cu2O/CuO不仅具有优异的抑菌性能,还提高了传统抗生素的药用价值,在医疗器械和医用材料等领域具有广泛的应用前景。
附录:
-
图 6 Kanamycin、Cu2O/CuO和Cu2O/CuO-Kanamycin复合材料对大肠杆菌(E. coli) (a)、金黄色葡萄球菌(S. aureus) (b)和耐卡那霉素-沙门氏菌(D-Salm) (c)的抑菌圈直径曲线
Figure 6. Inhibition diameter profiles of Kanamycin, Cu2O/CuO and Cu2O/CuO-Kanamycin composites against Escherichia coli (E. coli) (a), Staphylococcus aureus (S. aureus) (b) and Kanamycin-resistant D-Salmonella (D-Salm) (c)
图 7 Cu2O/CuO-Kanamycin复合材料对大肠杆菌(a)、金黄色葡萄球菌(b)和耐卡那霉素-沙门氏菌(c)的菌落计数结果;Cu2O/CuO-Kanamycin复合材料在不同时间对大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的菌落数(d)和抑菌率(e)
Figure 7. Results of colony counting for Cu2O/CuO-Kanamycin composites against E. coli (a), S. aureus (b) and Kanamycin-resistant D-Salm (c); Number of colonies (d) and inhibition rate (e) of Cu2O/CuO-Kanamycin composites against E. coli, S. aureus and Kanamycin-resistant D-Salm at various times
图 9 大肠杆菌、金黄色葡萄球菌和耐药卡那霉素-沙门氏菌的纯菌((a)~(c))及加入Cu2O/CuO-Kanamycin纳米复合材料处理后对应的碘化丙啶(PI)染色结果图((d)~(f))
Figure 9. Plots of pure bacteria of E. coli, S. aureus and D-Salm ((a)-(c)), and the corresponding results of propidium iodide (PI) staining after treatment with addition of Cu2O/CuO-Kanamycin nanocomposites ((d)-(f))
表 1 Cu2O/CuO-Kanamycin复合材料对大肠杆菌、金黄色葡萄球菌和耐卡那霉素-沙门氏菌的最小抑菌浓度(MIC)值 (单位:105 CFU/mL)
Table 1 Minimal inhibit concentration (MIC) values of Cu2O/CuO-Kanamycin composites against E. coli, S. aureus and D-Salm (Unit: 105 CFU/mL)
Beta-bacteria Cu2O/CuO-Kanamycin composite material/(µg·mL–1 ) 0 10 20 30 40 50 60 70 E. coli 7.44 6.17 3.81 1.11 0.21 0.21 0.19 0.17 S. aureus 5.31 3.15 2.37 2.23 0.18 0.18 0.15 0.14 D-Salm 6.89 5.41 3.78 2.14 0.23 0.18 0.15 0.13 -
[1] HANADA S, PIRZADEH M, CARVER K Y, et al. Respiratory viral infection-induced microbiome alterations and secondary bacterial pneumonia[J]. Frontiers in Immunology, 2018, 9: 2640. DOI: 10.3389/fimmu.2018.02640
[2] 钟艾玲, 田敏, 刘艳全, 等. 氨基糖苷类抗生素的耐药机制研究进展[J]. 中国抗生素杂志, 2019, 44(4): 401-405. DOI: 10.3969/j.issn.1001-8689.2019.04.002 ZHONG Ailing, TIAN Min, LIU Yanquan, et al. Progress of resistance mechanism of aminoglycoside antibiotics[J]. Chinese Journal of Antibiotics, 2019, 44(4): 401-405(in Chinese). DOI: 10.3969/j.issn.1001-8689.2019.04.002
[3] 张小敏, 郭全友, 周国燕, 等. 壳聚糖协同乳酸链球菌素抗轻腌大黄鱼源特定腐败菌抑制效应研究[J]. 中国食品学报, 2022, 22(5): 259-270. ZHANG Xiaomin, GUO Quanyou, ZHOU Guoyan, et al. Chitosan synergises with streptozotocin lactate to inhibit specific spoilage organisms from lightly pickled rhubarb fish[J]. Chinese Journal of Food Science, 2022, 22(5): 259-270(in Chinese).
[4] GAO J, YAN Y, GAO S, et al. Heterogeneous Cu2O-SnO2 doped polydopamine fenton-like nanoenzymes for synergetic photothermal-chemodynamic antibacterial application[J]. Acta Biomaterialia, 2024, 173: 420-431. DOI: 10.1016/j.actbio.2023.11.009
[5] BOST M, HOUDART S, OBERLI M, et al. Dietary copper and human health: Current evidence and unresolved issues[J]. Journal of Trace Elements in Medicine and Biology, 2016, 35: 107-115. DOI: 10.1016/j.jtemb.2016.02.006
[6] DALECKI A G, CRAWFORD C L, WOLSCHENDORF F. Copper and antibiotics: Discovery, modes of action, and opportunities for medicinal applications[J]. Advances in Microbial Physiology, 2017, 70: 193-260.
[7] PATWARDHAN A, COWAN J A. Influence of charge and structure on the coordination chemistry of copper aminoglycosides[J]. Dalton Transactions, 2011, 40(8): 1795-1801. DOI: 10.1039/c0dt00704h
[8] MANNING T, PATEL H, WYLIE G, et al. Structural measurements and cell line studies of the copper-PEG-amikacin complex against Mycobacterium tuberculosis[J]. Bioorganic & Medicinal Chemistry Letters, 2015, 25(24): 5825-5830.
[9] VARAPRASAD K, LÓPEZ M, NÚÑEZ D, et al. Antibiotic copper oxide-curcumin nanomaterials for antibacterial applications[J]. Journal of Molecular Liquids, 2020, 300: 112353. DOI: 10.1016/j.molliq.2019.112353
[10] 吴迎花, 陈惠惠, 房迅, 等. Cu2O/CuO-四环素复合材料的协同抑菌性能[J]. 复合材料学报, 2023, 40(12): 6789-6799. WU Yinghua, CHEN Huihui, FANG Xun, et al. Synergistic antibacterial properties of Cu2O/CuO-tetracycline composites[J]. Acta Materiae Compositae Sinica, 2023, 40(12): 6789-6799(in Chinese).
[11] PU J, ZHANG Z, ZHANG H, et al. Efficacy of bactericides against potato common scab caused by streptomyces in Yunnan, China[J]. American Journal of Potato Research, 2022, 99(4): 326-335. DOI: 10.1007/s12230-022-09883-2
[12] WEI C, FAN C, XIE D, et al. Fabrication of cinnamaldehyde-entrapped ethosome nanoparticles as antimicrobial agent[J]. LWT, 2023, 181: 114760. DOI: 10.1016/j.lwt.2023.114760
[13] ÇETINKAYA E A, KOÇ A, KOÇ H K, et al. Synthesis, characterization and antimicrobial properties of silver complexes derived from 5, 6-dimethylbenzimidazol-2-ylidene[J]. Polyhedron, 2023, 237: 116383. DOI: 10.1016/j.poly.2023.116383
[14] MAILLARD A P V F, ESPECHE J C, MATURANA P, et al. Zeta potential beyond materials science: Applications to bacterial systems and to the development of novel antimicrobials[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2021, 1863(6): 183597. DOI: 10.1016/j.bbamem.2021.183597
[15] WANG J, FANG X, CHEN H, et al. Antibacterial properties of the flower shaped nano-CuFe2O4@MoS2 composites[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2024, 683: 133076. DOI: 10.1016/j.colsurfa.2023.133076
[16] HE Q, TIAN Y, WU Y, et al. Electrochemical sensor for rapid and sensitive detection of tryptophan by a Cu2O nanoparticles-coated reduced graphene oxide nanocomposite[J]. Biomolecules, 2019, 9(5): 176. DOI: 10.3390/biom9050176
[17] LIU S, ZHAO X, SUN H, et al. The degradation of tetracycline in a photo-electro-Fenton system[J]. Chemical Engineering Journal, 2013, 231: 441-448. DOI: 10.1016/j.cej.2013.07.057
[18] TRIVEDI M K, PATIL S, SHETTIGAR H, et al. Spectroscopic characterization of chloramphenicol and tetracycline: An impact of biofield[J]. Pharmaceutica Analytica Acta, 2015, 6(395): 19-21.
[19] 檀苗苗, 丁娅莉, 山鹏禹, 等. Cu2O/PTCDI复合材料的制备及其光催化活性[J]. 化工环保, 2020, 40(3): 322-328. DOI: 10.3969/j.issn.1006-1878.2020.03.016 TAN Miaomiao, DING Yali, SHAN Pengyu, et al. Preparation of Cu2O/PTCDI composites and their photocatalytic activity[J]. Environmental Protection of Chemical Industry, 2020, 40(3): 322-328(in Chinese). DOI: 10.3969/j.issn.1006-1878.2020.03.016
[20] WANG B, LI R, ZHANG Z, et al. Novel Au/Cu2O multi-shelled porous heterostructures for enhanced efficiency of photoelectrochemical water splitting[J]. Journal of Materials Chemistry A, 2017, 5(27): 14415-14421. DOI: 10.1039/C7TA02254A
[21] GHODSELAHI T, VESAGHI M A, SHAFIEKHANI A, et al. XPS study of the Cu@Cu2O core-shell nanoparticles[J]. Applied Surface Science, 2008, 255(5): 2730-2734. DOI: 10.1016/j.apsusc.2008.08.110
[22] LI L, LEI J, JI T. Facile fabrication of p-n heterojunctions for Cu2O submicroparticles deposited on anatase TiO2 nanobelts[J]. Materials Research Bulletin, 2011, 46(11): 2084-2089. DOI: 10.1016/j.materresbull.2011.06.033
[23] MAHMOUD M A, QIAN W, EL-SAYED M A. Following charge separation on the nanoscale in Cu2O-Au nanoframe hollow nanoparticles[J]. Nano Letters, 2011, 11(8): 3285-3289. DOI: 10.1021/nl201642r
[24] CHEN X, WANG X, FANG D. A review on C1s XPS-spectra for some kinds of carbon materials[J]. Fullerenes, Nanotubes and Carbon Nanostructures, 2020, 28(12): 1048-1058. DOI: 10.1080/1536383X.2020.1794851
[25] GUO H, CHENG J, MAO Y, et al. Fabricating different coordination states of cobalt as magnetic acid-base bifunctional catalyst for biodiesel production from microalgal lipid[J]. Fuel, 2022, 322: 124172. DOI: 10.1016/j.fuel.2022.124172
[26] DOU H, XU M, ZHENG Y, et al. Bioinspired tough solid-state electrolyte for flexible ultralong-life zinc-air battery[J]. Advanced Materials, 2022, 34(18): 2110585. DOI: 10.1002/adma.202110585
[27] SIVKOV D V, PETROVA O V, NEKIPELOV S V, et al. Quantitative characterization of oxygen-containing groups on the surface of carbon materials: XPS and NEXAFS study[J]. Applied Sciences, 2022, 12(15): 7744. DOI: 10.3390/app12157744
[28] WANG X L, LI Y, HUANG J, et al. Efficiency and mechanism of adsorption of low concentration uranium in water by extracellular polymeric substances[J]. Journal of Environmental Radioactivity, 2019, 197: 81-89. DOI: 10.1016/j.jenvrad.2018.12.002
[29] ZHENG K, SETYAWATI M I, LIM T P, et al Antimicrobial cluster bombs: Silver nanoclusters packed with daptomycin[J]. ACS Nano, 2016, 10(8): 7934-7942.
[30] FRANCO D, CALABRESE G, GUGLIELMINO S P P, et al. Metal-based nanoparticles: Antibacterial mechanisms and biomedical application[J]. Microorganisms, 2022, 10(9): 1778. DOI: 10.3390/microorganisms10091778
[31] BERA S, ZHANEL G G, SCHWEIZER F. Antibacterial activities of aminoglycoside antibiotics-derived cationic amphiphiles: Polyol-modified neomycin B-, kanamycin A-, amikacin-, and neamine-based amphiphiles with potent broad spectrum antibacterial activity[J]. Journal of Medicinal Chemistry, 2010, 53(9): 3626-3631. DOI: 10.1021/jm1000437
[32] GODOY-GALLARDO M, ECKHARD U, DELGADO L M, et al. Antibacterial approaches in tissue engineering using metal ions and nanoparticles: From mechanisms to applications[J]. Bioactive Materials, 2021, 6(12): 4470-4490. DOI: 10.1016/j.bioactmat.2021.04.033
[33] CARRYN S, CHANTEUX H, SERAL C, et al. Intracellular pharmacodynamics of antibiotics[J]. Infectious Disease Clinics, 2003, 17(3): 615-634.
[34] BREZDEN A, MOHAMED M F, NEPAL M, et al. Dual targeting of intracellular pathogenic bacteria with a cleavable conjugate of Kanamycin and an antibacterial cell-penetrating peptide[J]. Journal of the American Chemical Society, 2016, 138(34): 10945-10949. DOI: 10.1021/jacs.6b04831
-
其他相关附件
-
目的
近年来,随着耐药细菌的快速增长,以传统抗生素为代表的抑菌剂药用价值逐步降低,这将对我国医药行业发展带来严重损失。因此,急需开发新型抗菌剂来解决细菌耐药和提升抗生素药效问题。本研究将实心纳米CuO/CuO材料与硫酸卡那霉素(Kanamycin)配位制备出CuO/CuO-Kanamycin复合材料,并通过实验探究复合材料的抑菌性能和机制。
方法本文以[Cu(NO)•3HO]为原料,水合肼为还原剂制备纳米氧化亚铜(CuO/CuO),最后通过“浸渍法”将硫酸卡那霉素(Kanamycin)负载到纳米氧化亚铜上得到CuO/CuO-Kanamycin复合材料。采用透射电子显微镜(TEM)、X射线衍射(XRD)、X射线光电子能谱分析仪(XPS)、傅里叶变换红外光谱仪(FT-IR)、紫外可见分光光度计(UV-vis)以及理论计算化学等对CuO/CuO-Kanamycin复合材料的微观结构、表面形貌和键合方式进行了系统表征;以革兰氏阳性菌金黄色葡萄球菌 ()、革兰氏阴性菌大肠杆菌 ()和耐药菌沙门氏菌()为模式菌,利用滤纸片扩散、菌落计数和最小抑菌浓度研究CuO/CuO-Kanamycin复合材料的抑菌性能;并通过Zeta电位、PI染色和细胞质物质泄露探究其抑菌机制。
结果表征结果显示,制备的实心立方体CuO/CuO结构,因与空气有较小的接触面积而相对稳定,可与Kanamycin的-OH基团相互吸引并发生配位键合,理论计算进一步证实了CuO可以与Kanamycin形成稳定的复合物。抑菌活性表明,与单独使用Kanamycin相比,CuO/CuO-Kanamycin复合材料对 和的抑菌效率分别提高了2.25 ± 0.01、2.0 ± 0.05和2.44 ± 0.01倍。与CuO/CuO材料相比,复合材料对和的抑菌效果分别提高了2.57 ± 0.02、2.28 ± 0.01和2.78 ± 0.06倍。CuO/CuO-Kanamycin复合材料最佳抑菌时间为20 min,对的最小抑菌浓度为30 g/mL,对和的最小抑菌浓度为40 g/mL。复合材料和 、 、 作用 5 min 测得表面电位值分别为-11.66 mV、-11.60 mV、-12.53 mV。作用40 min后测得表面电位为-4.92 mV、-5.68 mV、-6.08 mV,可以看出三种测试菌的细胞膜表面的Zeta电位值与对照组相比,实验组电荷均向正向移动。加入纳米复合材料并作用一段时间后,在 260 nm 处、、的吸光度分别从0.34、0.30和0.23上升到0.62、0.55和0.46。以150 μg/mL复合材料作用、 、后,PI能渗透受损细胞的细胞膜进入细胞内部对DNA进行染色。
结论CuO/CuO-Kanamycin复合材料对 、和均具有较高的抑菌活性,并且对效果最好。与单独使用CuO/CuO和Kanamycin相比,复合材料的抑菌效率更高,其可释放Cu和Cu,破坏细胞壁和细胞膜后,Kanamycin中的羟基可以有效地靶向细胞内细菌,干扰其核糖体功能(通过与rRNA 16S亚基上的A位点区域结合)来影响其抗菌活性,导致蛋白质生物合成的中断,最终细胞死亡。
-
大量耐药菌的出现以及抗生素药用价值的降低,迫切需要人们开发出新型抑菌剂来解决这类难题。无机纳米材料Cu2O具有低毒、强抑菌性能、高经济效应等优点被广泛应用于工业生产。硫酸卡那霉素具有高效、广谱的抑菌性能,但由于硫酸卡那霉素的药用价值逐步丧失,这将对我国抗生素行业造成重大的资源浪费和经济损失。
本文通过化学还原法,使用[Cu(NO3)2•3H2O]和N2H4•H2O制备纳米氧化亚铜(Cu2O/CuO),并通过与硫酸卡那霉素(Kanamycin)中的羟基(-OH)配位,成功合成了卡那霉素协同Cu2O/CuO纳米复合材料。选取革兰氏阴性菌大肠杆菌、革兰氏阳性菌金黄色葡萄球菌和耐药卡那霉素-沙门氏菌为模型菌,系统研究了卡那霉素协同Cu2O/CuO纳米复合材料的抑菌性能,并探究了其抗菌作用机制。该材料不仅可提升传统抗生素的药用和经济价值,且可对卡那霉素再次利用提供实验依据。
复合材料的抑菌机制图





 下载:
下载: