Preparation of mussel-inspired porous magnetic materials for application in immobilized lipase
-
摘要:
本文制备了一种以磁性壳聚糖为基材的多孔复合材料,通过在其表面涂覆聚多巴胺涂层替代传统的交联剂,用于脂肪酶的固定化研究。该材料具有优异的孔结构和较大的比表面积,孔容积可达
0.6028 mL/g,比表面积可达106.8239 m2/g,经优化后固定化脂肪酶的酶活可达(7392.91 ±121.22) U/g-载体。进一步探究了固定化酶的酶学性质,得到最佳反应温度为50℃,最佳反应pH为7.0,制备的固定化酶具有优异的热稳定性和pH稳定性,经过5次循环使用后,该固定化酶可以保持80%以上的初始酶活,经过10次循环使用后仍能保持52%的初始酶活。最后,将固定化酶应用于生物柴油转化并优化了相关工艺参数。Abstract:In this study, a porous composite material based on magnetic chitosan was prepared for lipase immobilization by applying a polydopamine coating on its surface instead of the traditional cross-linking agent. The material had excellent pore structure and large specific surface area, with a pore volume of
0.6028 mL/g and a specific surface area of106.8239 m2/g, and the highest enzyme activity of the immobilized lipase could reach up to(7392.91 ±121.22) U/g-carrier. In addition, the enzymatic properties of the immobilized enzyme were investigated, and the optimal reaction temperature and pH were 50℃ and 7.0, respectively. Furthermore, the prepared immobilized enzyme exhibited good thermal and pH stabilities, and could maintain above 80% of the initial enzyme activity by the immobilized enzyme after five cycles of reuse, while 52% of the initial enzyme activity could be still maintained after ten cycles of reuse. Finally, the immobilized enzyme was applied in biodiesel conversion and the process was optimized.-
Keywords:
- magnetic materials /
- mussel-inspired /
- lipase /
- enzymatic properties /
- biodiesel conversion
-
脂肪酶作为一类可以催化众多合成反应的生物催化剂,由于其高效、特异性强、反应条件温和等优点,广泛应用在油脂加工、风味酯合成、洗涤剂制造、纺织工业、药物合成等行业中[1-6]。但游离酶存在着难以回收、操作稳定性差等问题,极大地限制了脂肪酶的应用空间[7-8]。而将游离酶固定在载体上不仅能够增强酶在不同条件下的稳定性,同时实现酶制剂的重复利用,还可以有效降低酶催化剂在实际应用中的成本[9]。
载体是影响固定化酶的重要因素之一,壳聚糖(CS)作为自然界中储量极为丰富的天然多糖,具有良好的生物相容性、廉价易得等优点,是一种优秀的涂覆材料。但由于壳聚糖分子表面氨基数量有限,实际应用中存在局限性[10]。多孔材料具有一定数量和尺寸的孔隙结构,这些结构可以极大地提高材料的比表面积,从而达到增加载体与脂肪酶分子之间结合位点的目的[11]。而多巴胺(DA)作为贻贝仿生化学中一类新型改性剂,在碱性条件下,能够在多种载体表面氧化自聚形成聚多巴胺(PDA)涂层。聚多巴胺具有丰富的酚羟基、氨基和亚胺基等活性基团,同时具有较强的粘附性和良好的生物相容性,可以在不使用其他交联剂(如戊二醛)的条件下,将酶通过共价键固定在载体上[12]。而磁性复合材料可以在外加磁场下使固液迅速分离,进而增强固定化酶在工业应用中的优势[13]。Amin等[14]将漆酶固定在磁性微球表面用于降解芝麻油中的酚类物质,经过20个循环后,苯酚降解率超过70%。高丰琴等[15]将氯过氧化物酶固定在磁性复合材料表面,该固定化酶对有机废水中蒽醌类染料的降解率可达到83%。胡艺凡等[16]将过氧化氢酶固定在Ni2+修饰的Fe3O4颗粒表面,在最佳反应条件下,对过氧化氢的清除率可达到84%。
因此,本文采用共沉积法制备了一种贻贝仿生修饰的多孔磁性壳聚糖颗粒,利用聚多巴胺与脂肪酶之间的多种作用力,将脂肪酶固定在载体表面。通过对合成的固定化酶载体进行扫描电镜(SEM)、能谱(EDS)、透射电镜(TEM)、红外光谱(FTIR)、X射线衍射(XRD)等表征,分析材料的性质。在此基础上,对脂肪酶的固定化工艺条件和酶学性质进行研究,进一步考察其生产生物柴油的催化效率,为固定化脂肪酶的工业化应用提供数据支持。
1. 材料与方法
1.1 原材料
脂肪酶(Lipase,来源于黑曲霉,后文记为Lip),上海麦克林生化科技股份有限公司;FeCl3、壳聚糖(BR)、柠檬酸三钠,国药集团化学试剂有限公司;FeSO4、CuSO4、H2O2、对硝基苯酚(AR),天津市大茂化学试剂厂;棕榈酸对硝基苯酯(p-Npp)、盐酸多巴胺,上海阿拉丁生化科技股份有限公司;氨水、盐酸、乙酸、NaOH、Na2HPO4、NaH2PO4、甘油,天津市科密欧化学试剂公司;Na2CO3,天津市光复科技发展有限公司;Tris,北京索莱宝科技有限公司;乙醇,天津市富宇精细化工有限公司;大豆油,山东鲁花集团。
1.2 实验方法
1.2.1 磁性壳聚糖微球的制备
在三口烧瓶中加入2.25 g FeCl3和1.61 g FeSO4,随后加入100 mL去离子水,在氮气保护条件下加热至85℃,保持高速搅拌,加入10 mL浓氨水,待溶液变黑后迅速加入0.153 g柠檬酸三钠,反应30 min。随后将0.24 g壳聚糖溶于浓度为1% (v/v)的40 mL乙酸溶液中混合均匀,加入到上述反应体系中,继续反应30 min。反应结束后加入40 mL浓度为1 mol/L的NaOH溶液,静置10 min,接着用去离子水、乙醇交替洗涤得到磁性壳聚糖微球,记为Cs-Fe3O4,保存在去离子水中。
1.2.2 贻贝仿生功能化微球的制备及表征
取500 mg磁性壳聚糖微球均匀分散在250 mL pH为8.5的Tris-HCl缓冲液中,加入300 mg盐酸多巴胺(DA),在室温条件下,于180 r/min条件下反应14 h,随后加入120 mg CuSO4和300 μL H2O2,继续反应2 h,经乙醇洗涤后,真空干燥得到聚多巴胺修饰的磁性微球(记为PDA-Cs-Fe3O4)。
采用JSM 7800 F 型场发射扫描电子显微镜(日本电子株式会社)和美国FEI Tecnai G2 F30场发射超高分辨率透射电镜观察材料形貌,采用X-Max50能量色散光谱仪(英国牛津仪器公司)分析材料表面元素变化。采用Spectrum 10傅里叶红外光谱仪(美国珀金埃尔默仪器有限公司)分析材料表面的基团变化。晶体结构分析采用德国D8 Advance X射线多晶衍射分析仪(XRD)。采用美国Lake Shore 7404振动样品磁强计(VSM)测定固定化酶的磁性状态。BET分析采用BSD-660 M全自动高精度比表面积及微孔分析仪(北京贝士德仪器科技有限公司)。
1.2.3 固定化酶的制备及工艺优化
将100 mg PDA-Cs-Fe3O4溶于5 mL摩尔浓度为50 mmol/L的磷酸缓冲溶液中,超声使其均匀分散在溶剂中,然后与5 mL一定浓度的脂肪酶液混合后,在200 r/min条件下固定6 h,进一步用去离子水洗涤,冷冻干燥得到固定化脂肪酶(记为Lip-PDA-Cs-Fe3O4)。
以最优固定化条件下的酶活为100%,比较不同固定化条件下固定化酶的相对酶活,研究在固定化过程中不同温度(20℃、25℃、30℃、35℃、40℃),pH (4.0、5.0、6.0、7.0、8.0、9.0),初始酶浓度(2、3、4、5、6 mg/mL),时间(3、4、5、6、7、8 h)对固定化酶酶活的影响。
1.2.4 游离酶及固定化酶的酶学性质研究
1.2.4.1 最佳反应温度及热稳定性
将游离酶及制备的固定化酶分别在30℃、40℃、50℃、60℃、70℃的条件下催化底物进行反应,以该组数据中的最大酶活为100%,比较相对酶活,确定最佳反应温度。接着分别测定在最佳反应温度下,反应不同时间(0、2、4、6、8 h)对游离酶及固定化酶相对酶活的影响,研究最佳反应温度下的热稳定性。
1.2.4.2 最佳反应pH及pH稳定性
分别在不同pH(5.0、6.0、7.0、8.0、9.0)条件下测定游离酶及固定化酶的酶活,确定最佳反应pH,接着测定二者在不同pH条件下处理2 h后的酶活,以处理前的最佳反应条件下的酶活为100%,分析固定化酶的pH稳定性。
1.2.4.3 重复使用性
在固定化酶催化底物反应结束后,通过磁分离将固定化酶从反应溶液中分离出来,用磷酸缓冲溶液(pH 7.0,0.02 mol/L)洗涤3次后重新加入溶剂及底物进行新一轮的催化反应,重复操作10次,测定每次循环后固定化酶的剩余酶活,以第一次使用后的酶活为100%,评估固定化酶的重复使用性。
1.2.4.4 储藏稳定性
将制备的固定化酶于4℃条件下储藏30 d,以第0 d的酶活力为100%,每隔5 d测定其酶活,评估固定化酶的储藏稳定性。
1.2.4.5 酶促动力学
改变反应体系中底物的浓度,分别加入适量固定化酶与游离酶,将测得的酶活数据通过GraphPad Prism 8进行非线性拟合,计算并比较二者的酶促动力学参数,其中,Km代表该固定化酶达到最大反应速度一半时的底物浓度,Vmax为该固定化酶在酶促反应中的最大反应速度。
1.2.5 固定化酶在生物柴油转化中的应用
按照邵文泰[17]的方法,在锥形瓶中加入4 g大豆油、甲醇及去离子水,随后加入一定量的固定化酶,振荡均匀,置于50℃转速为240 r/min摇床中反应24 h,计算生物柴油转化率。
1.2.6 酶活测定
根据罗旭聪[18]的方法,在1.5 mL的磷酸缓冲溶液(pH 7.0,0.02 mol/L)中,加入10 mg固定化酶和100 μL 棕榈酸对硝基苯酯(p-Npp,质量浓度为5 mg/mL),振荡均匀后,置于50℃水浴中反应10 min,随后迅速加入200 μL Na2CO3溶液(质量分数为10wt%)。将离心后的上清液适当稀释,用SpectraMax Plus384酶标仪(上海仪电科学仪器有限公司)测定其在410 nm波长下的吸光度,每组实验设置3个平行,根据上清液中对硝基苯酚的含量计算脂肪酶的酶活。
酶活力(U/g-载体)定义为:将单位时间(min)内单位质量(g)固定化酶催化单位摩尔质量(nmol)底物所需的酶量定义为1个酶活单位。
1.2.7 生物柴油转化率的测定
1.2.7.1 甘油测定标准曲线的绘制
配制质量浓度为0.01 g/mL的甘油溶液,稀释至0.003、0.004、0.005、0.006、0.007、0.008、0.009 g/mL后分别加入到各离心管中,每组设置3个平行,随后加入700 μL的NaOH溶液(质量浓度为0.05 g/mL)和200 μL的CuSO4溶液(质量浓度为0.05 g/mL),充分混合均匀,离心后用UV-5100紫外可见分光光度计(上海元析仪器有限公司)测定上清液在630 nm波长下的吸光度[17],进一步绘制甘油浓度测定的标准曲线。
1.2.7.2 甘油浓度及催化反应转化率的测定
将反应结束后的溶液静置分层,取下层溶液,稀释适当倍数后加入NaOH溶液和CuSO4溶液并充分混匀,离心后测定上清液在630 nm波长下的吸光度,每组实验设置3个平行,然后根据甘油浓度测定的标准曲线计算出反应后溶液中的甘油浓度值。
生物柴油转化率计算方法如下式所示:
转化率(%)=nM1C1V1m1M2×100\% (1) 式中:n为稀释倍数;M1为豆油的摩尔质量(g/mol);C1为实际甘油浓度(g/mL);V1为反应体系中下层溶液的体积(mL);m1为初始豆油质量(g);M2为甘油的摩尔质量(g/mol)。
1.2.7.3 水油比对转化率的影响
在离心管内加入一定量的大豆油与固定化酶,然后分别加入不同质量的去离子水,使水油比(m/m)分别为3%、4%、5%、6%、7%,再加入0.42 g甲醇,在50℃、240 r/min的摇床中反应24 h后,参照1.2.7.2的实验步骤测定并计算不同水油比下的转化率。
1.2.7.4 加酶量对转化率的影响
在离心管内加入一定量的大豆油与去离子水,分别加入不同质量的固定化酶(300、400、500、600、700 mg),再加入0.42 g的甲醇,在50℃、240 r/min的摇床中反应24 h,参照1.2.7.2的实验步骤测定并计算生物柴油的转化率。
1.2.7.5 反应时间对转化率的影响
在离心管内加入一定量的大豆油、去离子水和甲醇,参照1.2.7.2的实验步骤测定并计算不同反应时间下生物柴油的转化率。
得到固定化酶催化最佳条件后,在相同条件下,测定游离酶在生物柴油反应体系中的转化率,比较固定化酶与游离酶的催化效果。
2. 结果与分析
2.1 固定化载体的表征
2.1.1 采用SEM、EDS及TEM分析材料形貌变化
图1为扫描电镜、透射电镜观察到的材料形貌。由图1(a)和图1(b)可以看出,与真空干燥后Fe3O4颗粒相比,磁性壳聚糖颗粒表面并未发生明显变化。由图1(c)可知,经聚多巴胺修饰后的磁性材料能够观察到多孔结构。由EDS分析可以看到,Fe3O4磁核表面不含N元素,而经壳聚糖修饰后,材料表面的N元素含量增加到1.1wt%,随着多巴胺的修饰,材料表面的N元素含量进一步增加到了4.8wt%。由此可以看出,N元素含量的变化与复合材料合成过程中成分的变化相对应,在磁核合成过程中,氨水为反应物提供了充足的—OH,Fe2+与Fe3+发生共沉积形成Fe3O4颗粒,当加入壳聚糖溶液后,醋酸与氨水发生剧烈的中和反应,溶液中的壳聚糖分子迅速包覆在Fe3O4颗粒上,使材料表面的N元素含量增加,接着用NaOH将溶液中包覆壳聚糖的磁性颗粒沉淀出来[19]。随后在进一步修饰过程中,多巴胺在弱碱性条件下氧化自聚形成聚多巴胺涂层,为复合材料表面引入了更多的氨基[20]。由图1(d)可以看到,该磁核的粒径约为10~20 nm,由图1(e)可以清晰地看到复合材料内被包裹的磁核。
2.1.2 FTIR分析材料表面修饰情况
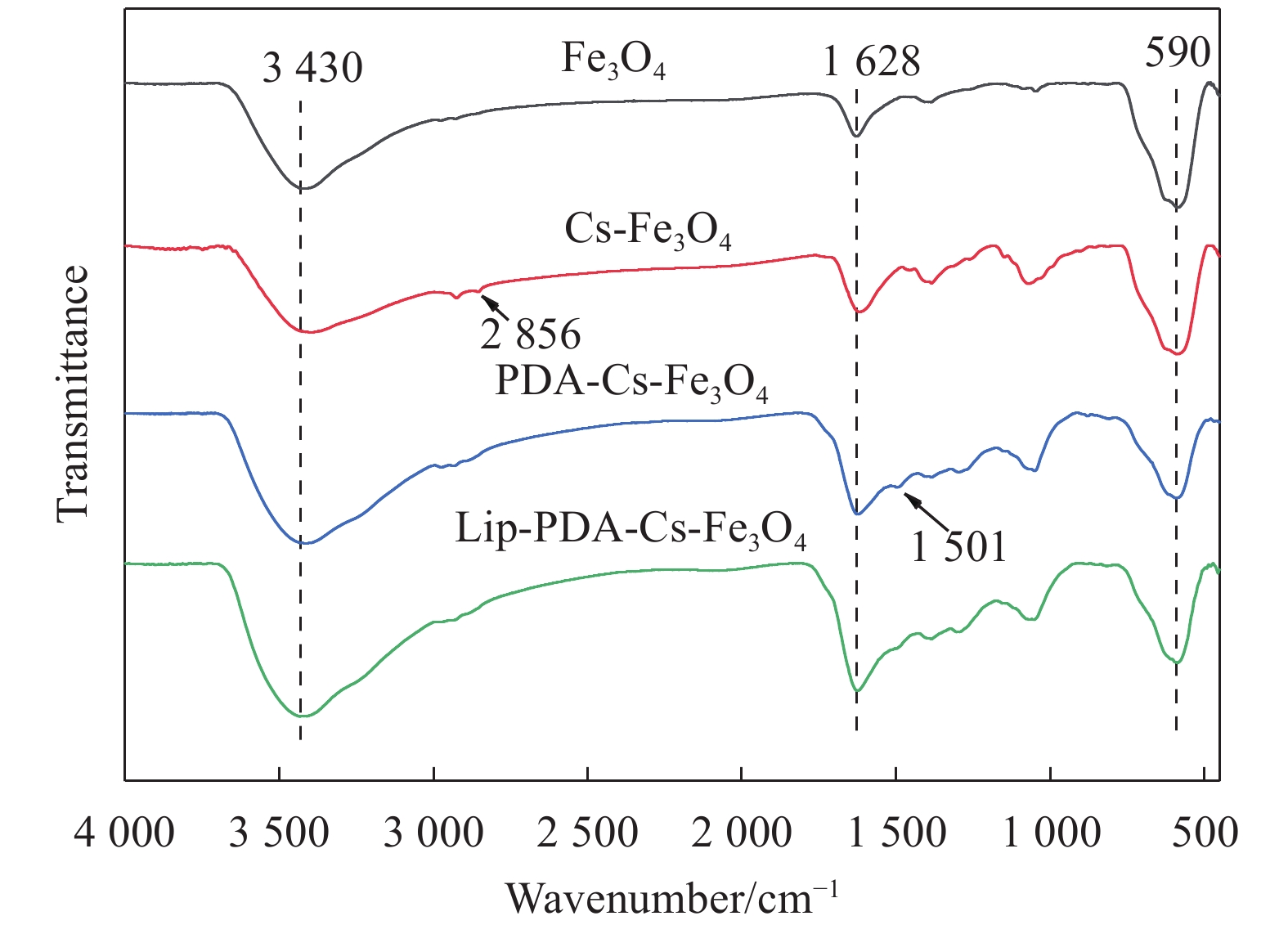
图2为Fe3O4、Cs-Fe3O4、PDA-Cs-Fe3O4的红外图谱,590 cm−1处为Fe—O键的特征吸收峰,说明修饰后的材料内都具有Fe3O4纳米粒子[21-22]。在壳聚糖修饰后,
1628 cm−1与3430 cm−1的特征吸收峰增强,可能是由于壳聚糖表面的N—H和—OH造成的,2856 cm−1出现的新峰可能为C—H的特征吸收峰,说明壳聚糖成功涂覆在磁性颗粒表面[23]。与Cs-Fe3O4相比,PDA-Cs-Fe3O4在1628 cm−1和3430 cm−1的吸收峰进一步增强,表明聚多巴胺的修饰使材料具有更多的氨基,而1501 cm−1的弱峰可能是N—H的剪切振动造成的[24]。通过Lip-PDA-Cs-Fe3O4的红外图谱可以观察到,1628 cm−1和3430 cm−1的吸收峰再次增强,这可能是由于脂肪酶表面具有丰富的氨基和羟基,更加充分地证明了脂肪酶已经成功固定在材料表面。2.1.3 XRD分析固定化酶晶体结构
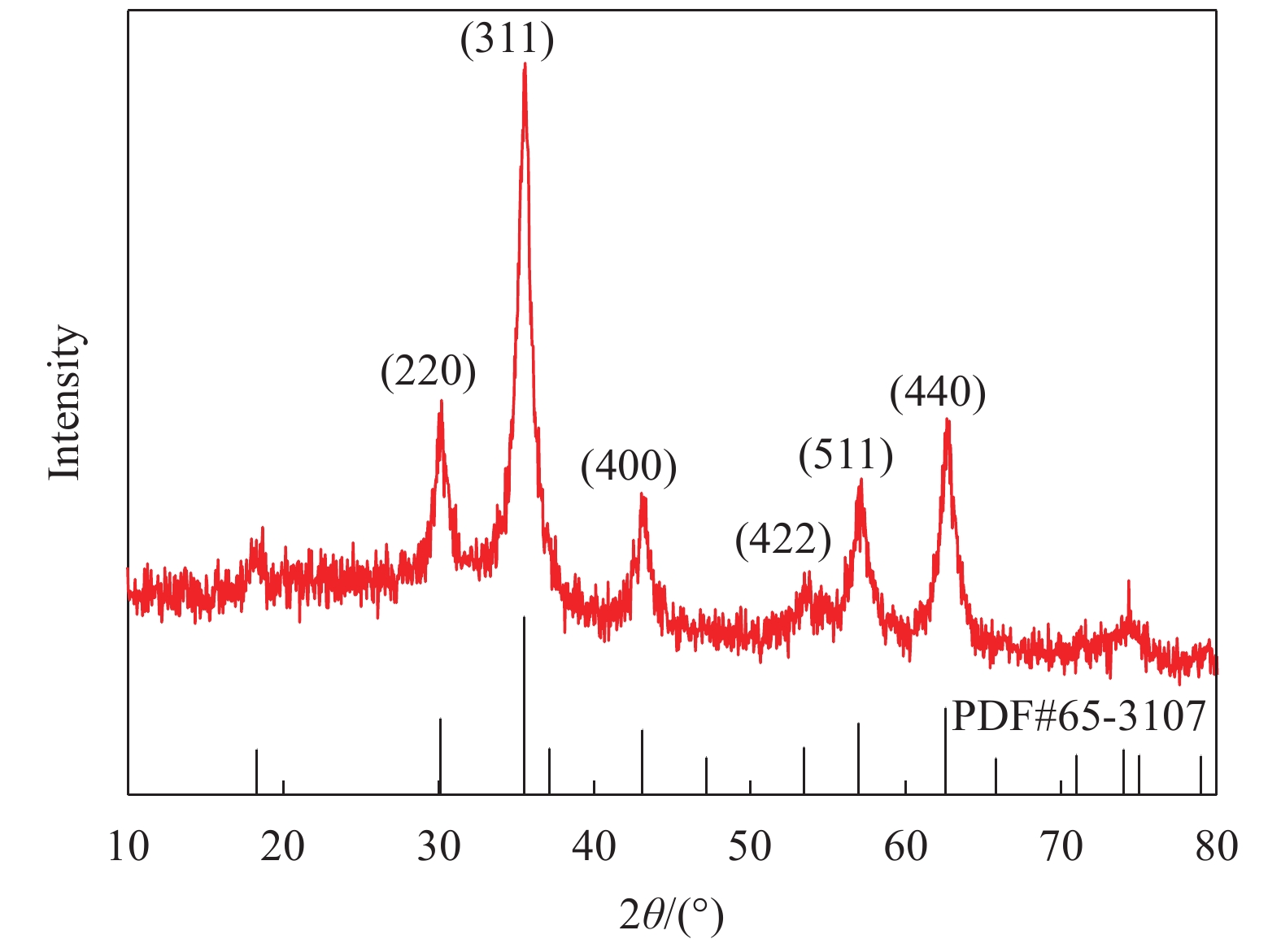
图3为Lip-PDA-Cs-Fe3O4的XRD图谱,可以看到在2θ=30.15°、35.53°、43.01°、53.80°、57.14°、62.64°处有6个衍射峰,均为标准Fe3O4的特征衍射峰(220)、(311)、(400)、(422)、(511)、(440),与标准卡片(JCPDS No.65-3107)基本一致,表明该固定化酶具有典型的单相四氧化三铁的尖晶石结构,并且在壳聚糖和聚多巴胺的修饰过程中Fe3O4的晶体结构并未发生改变[25]。
2.1.4 VSM分析固定化酶的磁性状态
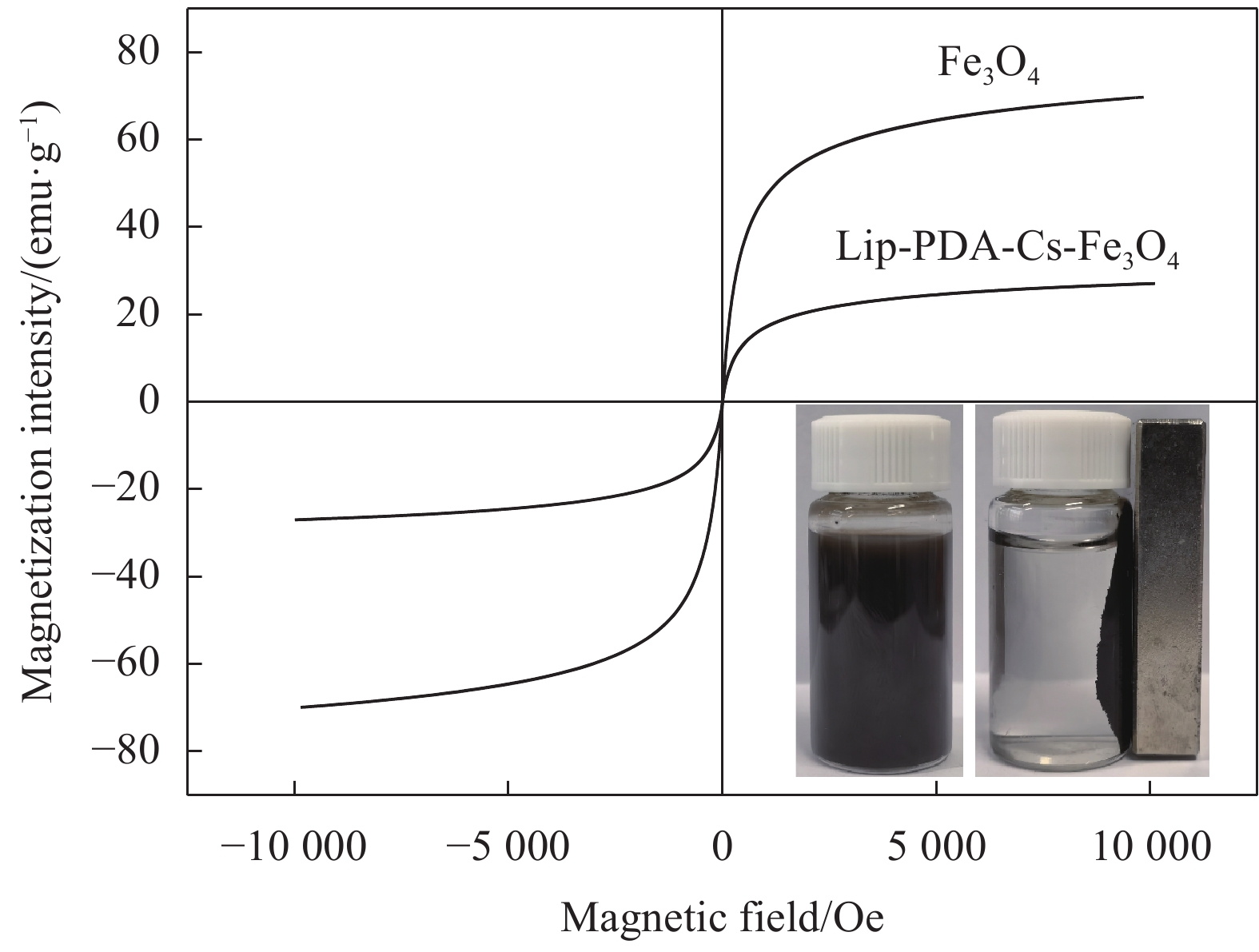
图4为Fe3O4颗粒与Lip-PDA-Cs-Fe3O4的磁滞回线图谱,由图可知,二者都呈现出典型的S型磁滞回线,最大饱和磁化强度分别为69.793 emu/g与27.02 emu/g,对比发现固定化酶的磁化强度低于Fe3O4颗粒的磁化强度,这可能是由于随着壳聚糖等聚合物修饰在磁性颗粒表面,聚集在表面的聚合物逐渐增多,复合材料中Fe3O4颗粒的含量减少,从而削弱了该固定化酶的磁化强度[26-27]。由图4插图中Lip-PDA-Cs-Fe3O4的磁分离图片可知,虽然磁化强度下降,但在外加磁场下,该固定化酶依然可以在40 s内实现快速分离,证明该固定化酶具有超顺磁性和良好的磁响应性。
2.1.5 比表面积(BET)及孔径分析
表1为载体与固定化酶的BET分析结果,PDA-Cs-Fe3O4与Lip-PDA-Cs-Fe3O4的比表面积分别为
106.8239 m2/g和77.6027 m2/g,孔体积由0.6028 mL/g下降至0.4449 mL/g。比表面积和孔体积的减小是由于脂肪酶分子在固定化过程中堵塞了部分孔隙[28]。表2为PDA-Cs-Fe3O4的孔径分析结果,由T-plot理论与BJH理论得到PDA-Cs-Fe3O4的孔径分布情况,该材料同时具有大孔和介孔结构,有着较大的孔容积,孔隙结构可以极大地提高材料的比表面积,从而达到增加载体表面与脂肪酶之间结合位点的目的[29-31]。表 1 PDA-Cs-Fe3O4与Lip-PDA-Cs-Fe3O4的BET分析Table 1. BET analysis of PDA-Cs-Fe3O4 and Lip-PDA-Cs-Fe3O4Surface area/(m2·g−1) Pore volume/(mL·g−1) PDA-Cs-Fe3O4 106.8239 0.6028 Lip-PDA-Cs-Fe3O4 77.6027 0.4449 表 2 PDA-Cs-Fe3O4的孔径分析Table 2. Pore size analysis of PDA-Cs-Fe3O4Pore size/nm Pore volume/(mL·g−1) Percentage/% Micropore 0.35-2 0.0081 1.35 Mesopore 2-10 0.0589 9.84 10-50 0.2175 36.31 Macropore 50-120 0.3145 52.50 2.2 固定化酶的工艺优化
2.2.1 固定化温度
图5为固定化温度对酶活的影响,当固定化温度为20℃时,固定化酶的相对酶活较低,这可能是由于温度较低时,脂肪酶在反应体系中分散性较差,酶分子与载体之间的接触面积较小,不利于游离酶和载体之间发生席夫碱反应[32]。随着温度上升至30℃,固定化酶的相对酶活达到100%。温度继续增加至40℃,相对酶活降低至90%,这可能是由于部分游离酶在高温环境下失活导致酶活力下降[33]。因此,将30℃作为固定化酶的最佳固定化温度进行后续实验。
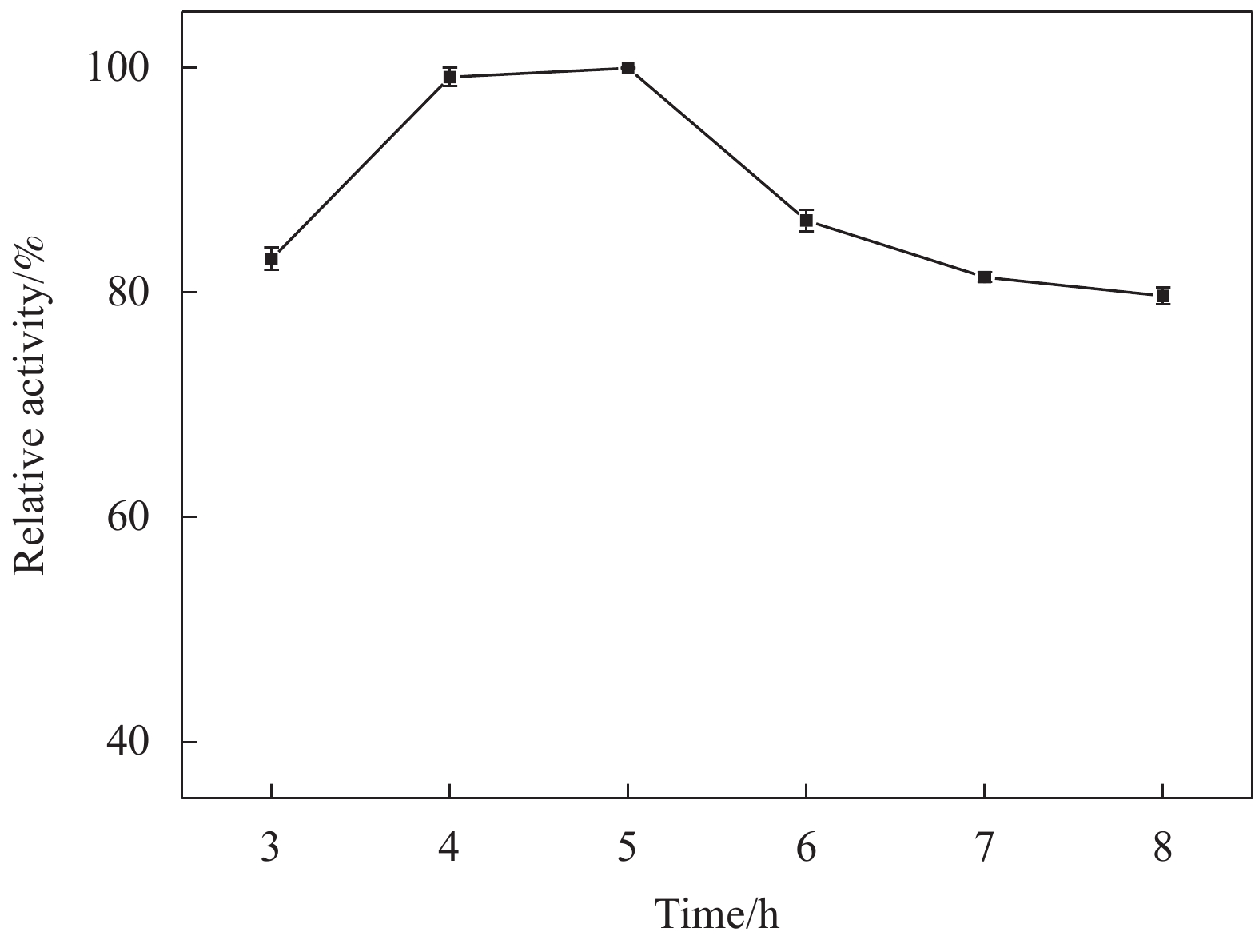
2.2.2 固定化时间
图6为固定化时间对酶活的影响,可以观察到随着固定化时间的增加,固定化酶的相对酶活呈现出先上升后下降的趋势。固定化时间为3 h时,相对酶活为83%,这可能是由于固定化时间为3 h时,体系中的游离酶还未充分的与载体结合[34]。而当固定化时间为5 h时,固定化酶的酶活达到最大值。当固定化时间继续增加至6 h时,固定化酶的相对酶活下降至86%,固定化时间为8 h时,相对酶活略有降低。这可能是由于载体表面结合的脂肪酶过多,脂肪酶的活性位点间产生空间位阻阻碍了底物与活性位点接触[35]。因此,确定5 h为制备固定化酶的最佳固定化时间。
2.2.3 固定化pH
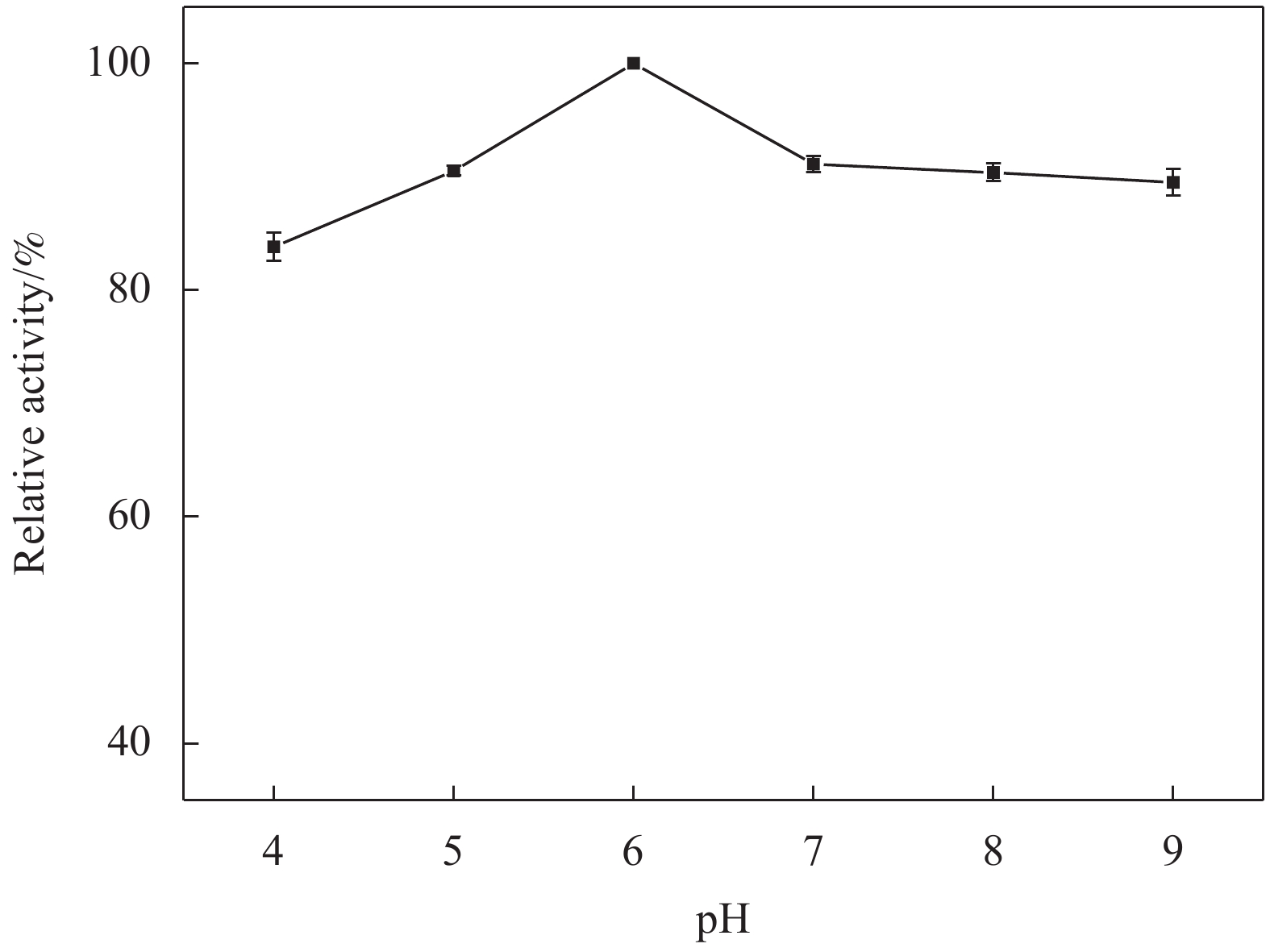
图7为优化固定化过程pH的数据,当pH为4.0时,相对酶活仅为84%,当pH为6.0时,相对酶活达到最大值。随着pH增加到9.0时,相对酶活下降至89%。这可能是由于pH主要影响固定化过程中酶的微观状态,过酸或过碱的环境都会造成酶分子构象的变化,从而影响脂肪酶与载体的结合[36]。因此,后续实验将pH 6.0作为最佳固定化pH。
2.2.4 初始酶浓度
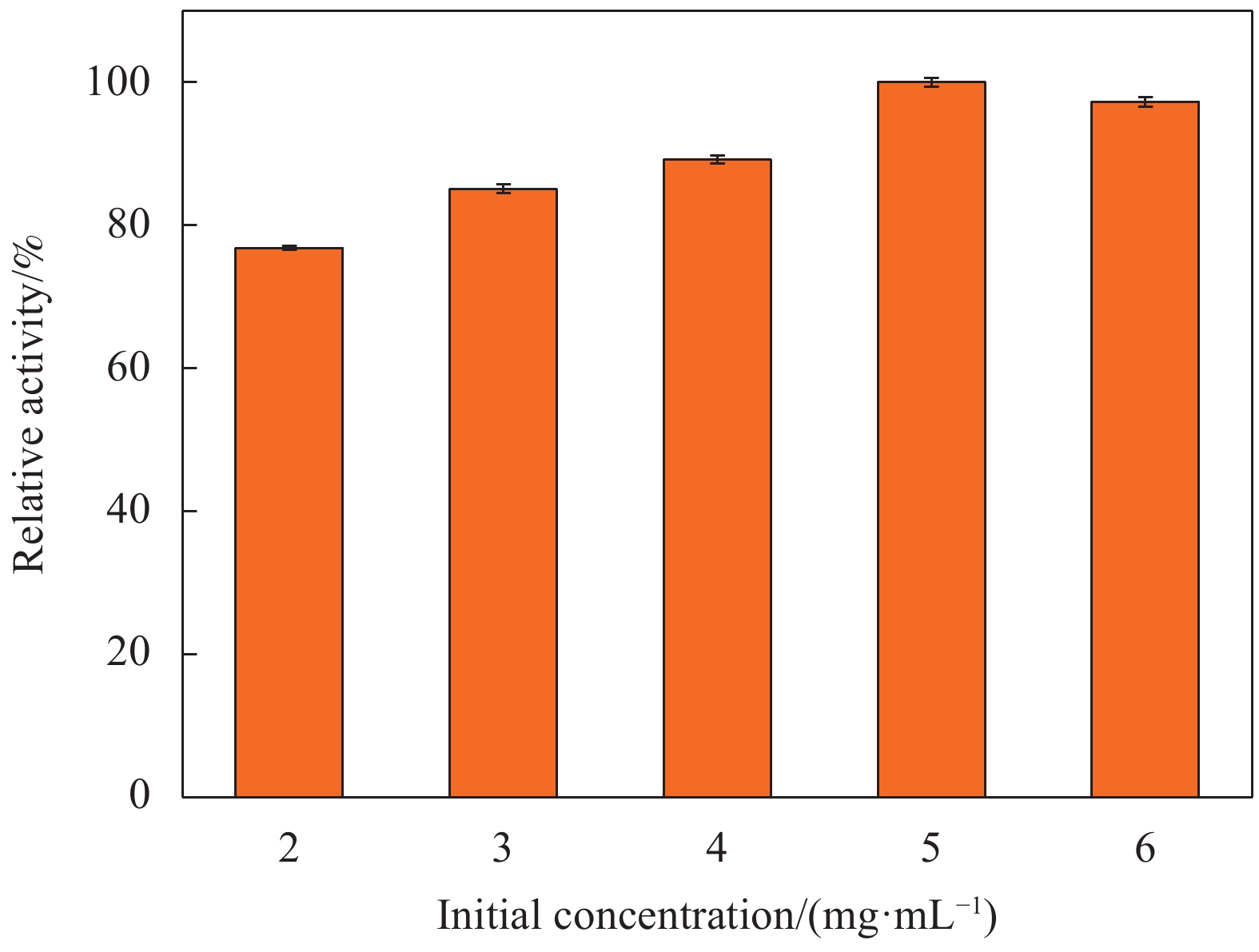
图8为初始酶浓度对固定化酶酶活的影响。当体系中酶浓度为2 mg/mL时,相对酶活为77%,随着初始酶浓度的增加,相对酶活逐渐增加至最大值,此时酶活达到(
7392.91 ±121.22) U/g-载体。当初始酶浓度增加至6 mg/mL时,相对酶活略微下降至97%。这可能是由于固定化过程中酶浓度过大时,酶分子之间紧密接触导致分子间空间传质阻力变大,阻碍了底物与活性中心的接触[37]。因此,后续实验将5 mg/mL作为最佳初始酶浓度。2.3 游离酶及固定化酶的酶学性质研究
2.3.1 最佳反应温度及热稳定性
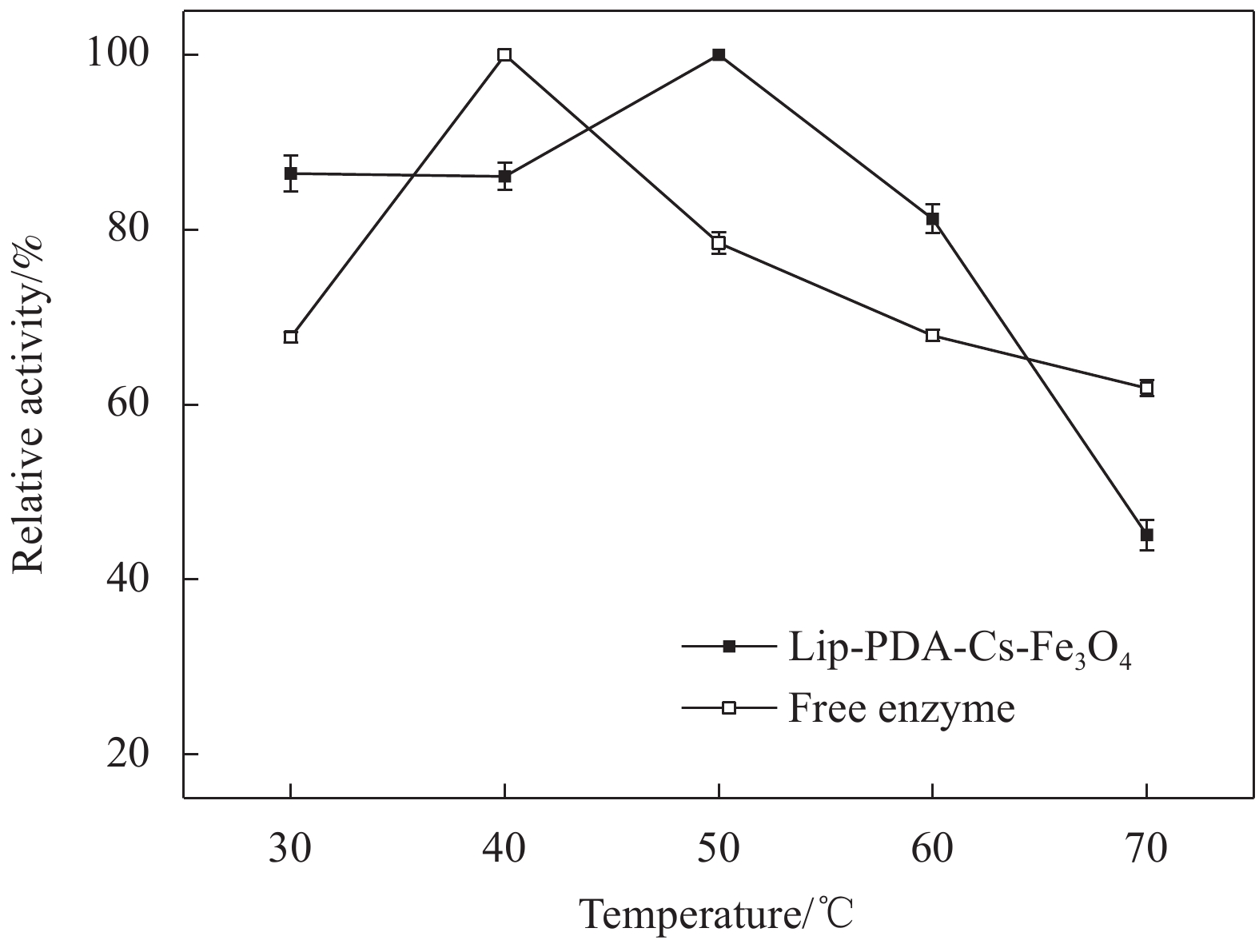
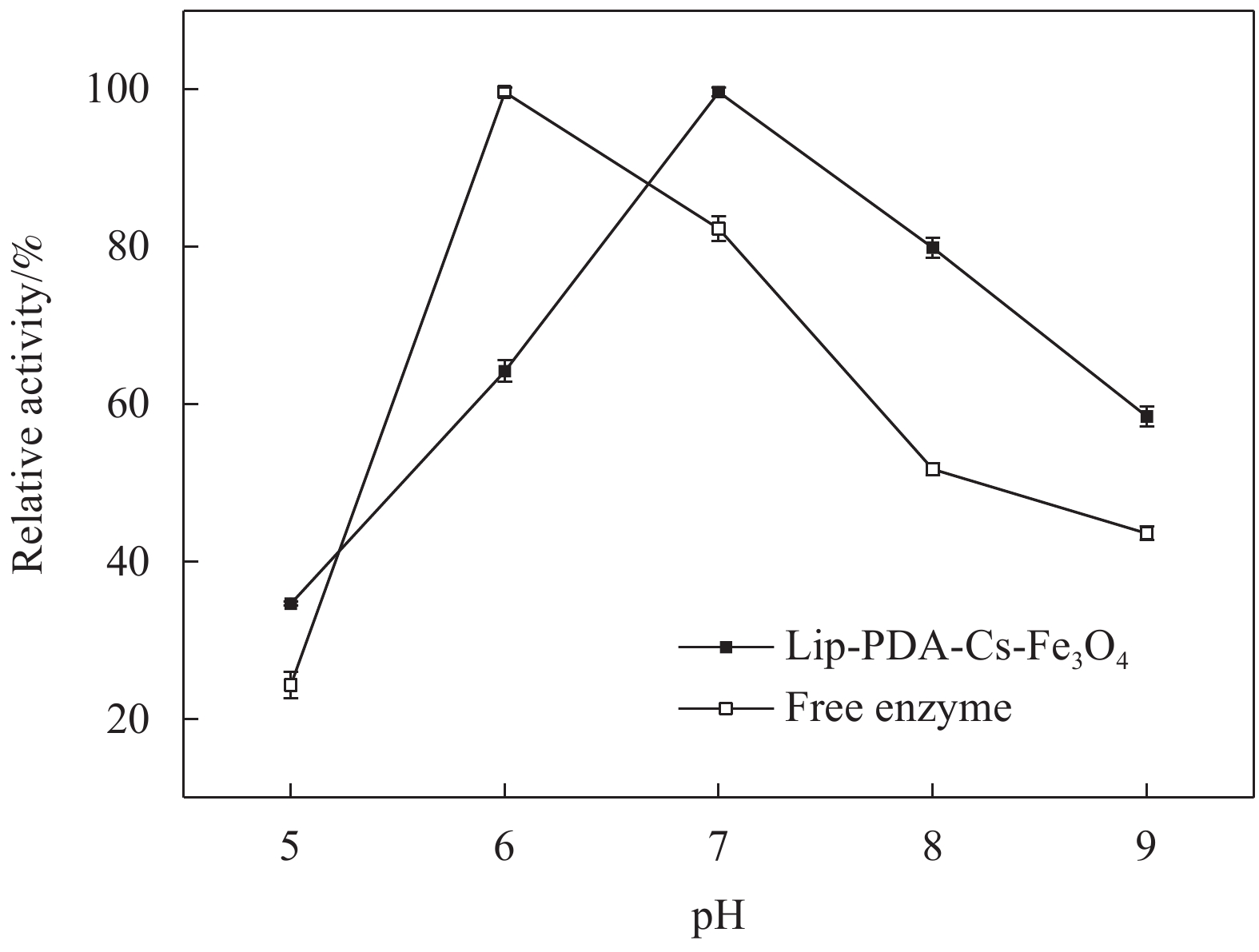
图9比较了游离酶与固定化酶的最佳反应温度,由图可知游离酶的最佳反应温度为40℃,固定化酶的最佳反应温度为50℃。并且,与游离酶相比,固定化酶在最佳反应温度附近的40℃和60℃的相对酶活分别为86%和81%,而游离酶在30℃和50℃的相对酶活为68%和78%。以上结果表明,固定化酶比游离酶具有更强的温度耐受性,这与其他研究中的结果类似[38]。
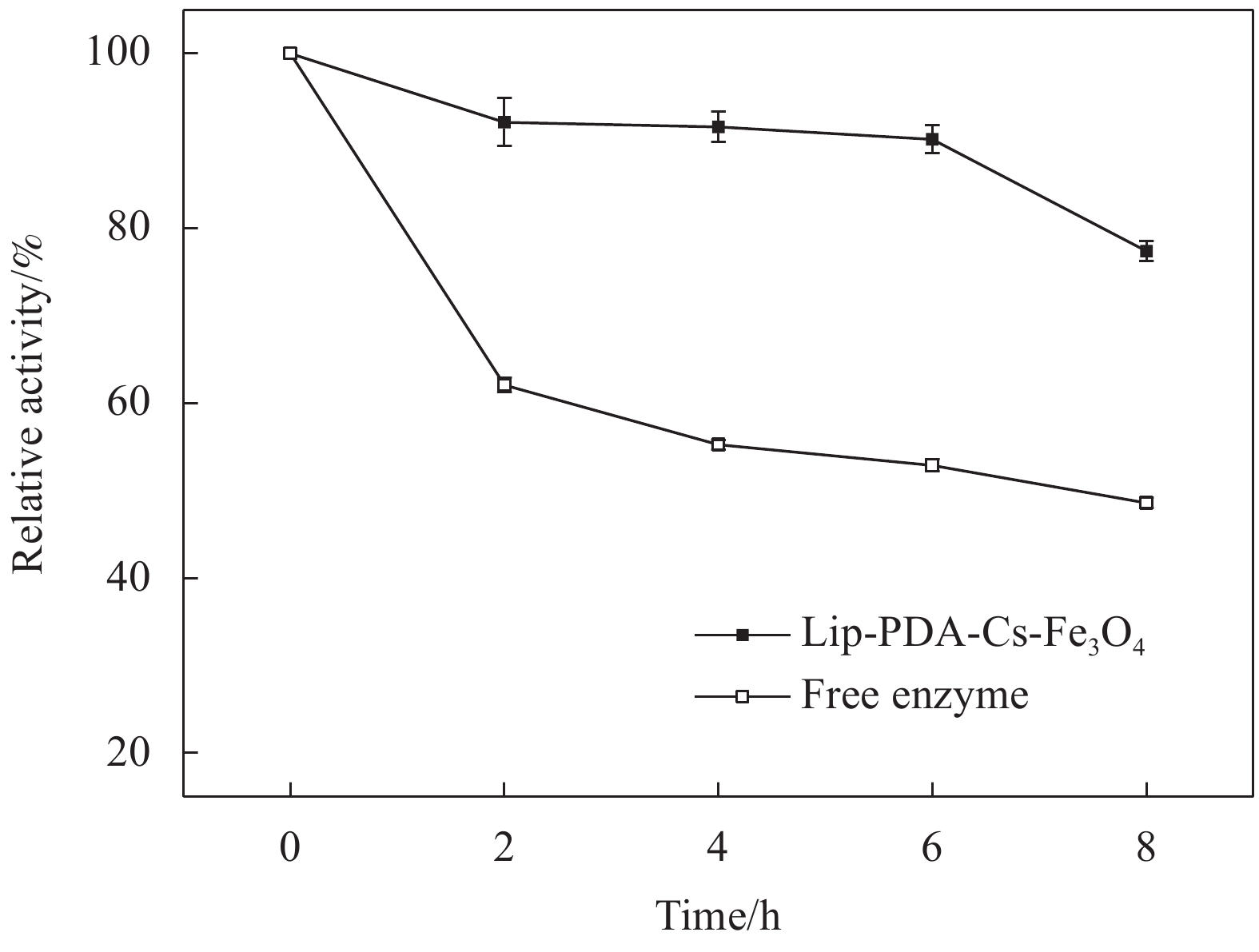
图10比较了游离酶与固定化酶的热稳定性。在最佳反应温度条件下,每隔2 h测定固定化酶与游离酶的相对酶活,进而评估固定化酶和游离酶的热稳定性。由图可以观察到固定化酶孵育6 h后相对酶活下降至90%,而孵育8 h后依然保持77%的相对酶活。而游离酶在孵育2 h相对酶活降至62%,而孵育8 h后相对酶活仅为49%。表3中显示了文献报道中使用不同方法制备的固定化酶的热稳定性数据。以戊二醛为交联剂的聚乙二醇/聚乳酸载体、以氢键为作用力的多孔聚丙烯酰胺水凝胶微球和环氧基功能化的SiO2载体制备的固定化酶,这3种固定化酶在50℃下分别孵育2 h、4 h、3 h后,相对酶活分别下降至初始酶活的70%、85%和80%以下,而本文中的固定化酶孵育6 h后仍然可以保持90%的相对酶活[39-41]。这可能是由于聚多巴胺涂层与酶分子中的氨基形成强力的共价键,限制了酶的构象变化,增加了酶分子结构的刚性,达到了提高其热稳定性的效果[42]。
表 3 Lip-PDA-Cs-Fe3O4与其他研究中固定化酶热稳定性的比较Table 3. Comparison of thermal stability of Lip-PDA-Cs-Fe3O4 with previous publications for immobilized lipaseTemperature/℃ Time/h Relative activity/% Ref. PEG/PLA/CRL 50 2 <70 [39] L-PHM3 4 <85 [40] PFL@EMMS 3 <80 [41] Lip-PDA-Cs-Fe3O4 6 90 This work Notes:Time is the duration of staying at 50℃; PEG—Polyethylene glycol; PLA—Polylactic acid; CRL—Candida rugosa lipase; L—Candida antarctica lipase; PHM—Polyacrylamide hydrogel microspheres; 3 is the concentration of phosphate buffer solution of lipase immobilized on polyacrylamide hydrogel microspheres; PFL—Pseudomonas fluorescens lipase; EMMS—Epoxy-functionalized macroporous and mesoporous SiO2. 2.3.2 最佳反应pH及pH稳定性
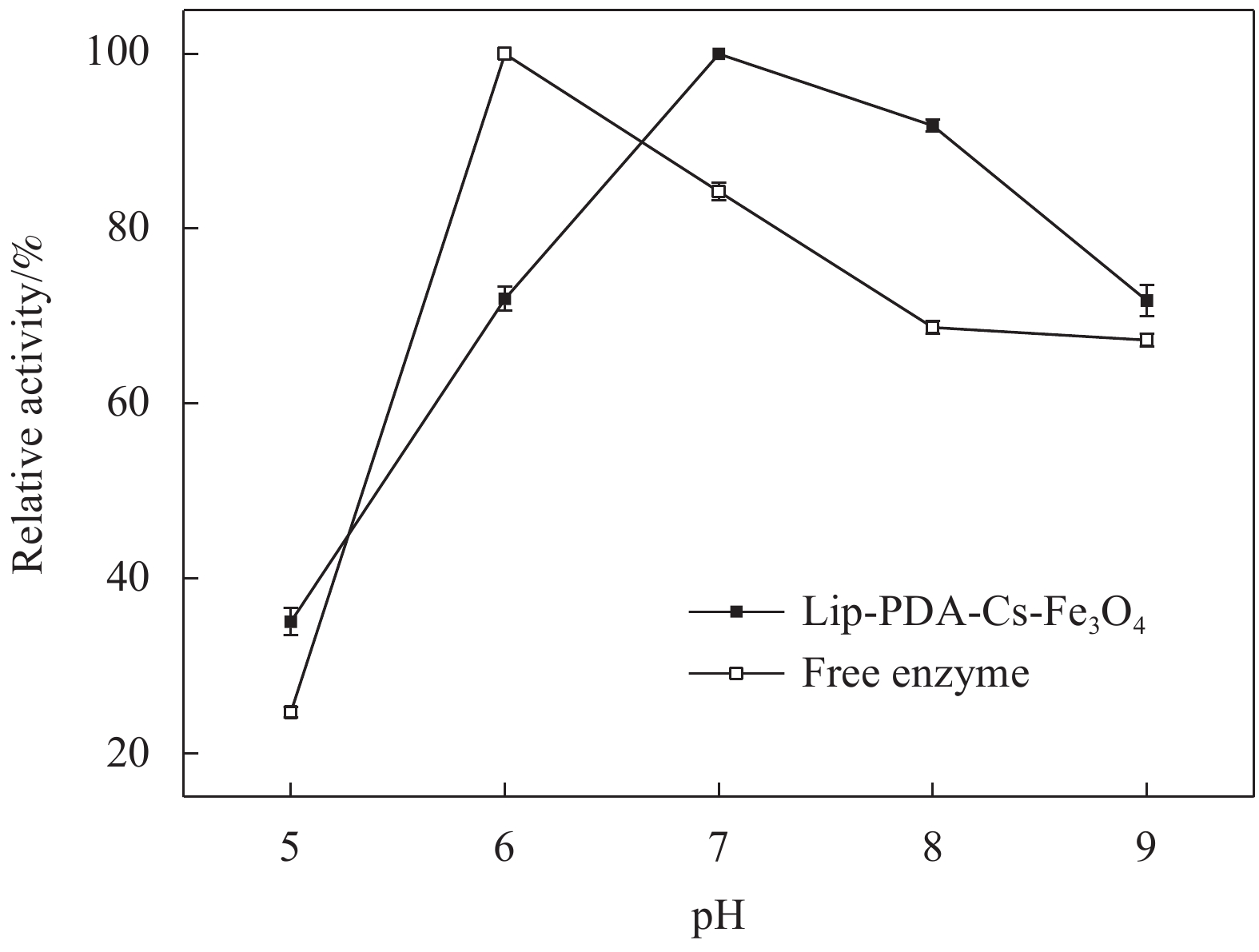
pH是影响游离酶与固定化酶活性的重要因素之一,图11确定了游离酶与固定化酶的最佳反应pH。由图中的变化趋势可以看出,脂肪酶的酶活强烈依赖于介质的pH值,游离酶在pH为6.0时表现出最大酶活,Lip-PDA-Cs-Fe3O4在pH为7.0时酶活达到最大值,并且当pH提高至8.0时,Lip-PDA-Cs-Fe3O4的相对酶活下降趋势与游离酶相比较缓,当pH提高至9.0时,Lip-PDA-Cs-Fe3O4的相对酶活下降至67%,优于游离酶的相对酶活。这可能是由于聚多巴胺涂层表面的碱性基团与反应介质间产生了等浓度的氢离子,改善了载体表面脂肪酶的微环境,抑制了脂肪酶的构象变化[43]。
图12为游离酶和固定化酶的pH稳定性数据,在图中可以观察到固定化酶与游离酶的变化趋势类似,随着pH的增加均呈现出先增大后减小的趋势。Lip-PDA-Cs-Fe3O4与游离酶在最适pH条件下均保持接近100%的相对酶活,并且在偏碱性的条件下,固定化酶也能够保持较高的相对酶活。表4为文献报道中使用不同方法制备的固定化酶的pH稳定性数据。以牛血清白蛋白(BSA)为交联剂制备的交联酶聚集体、羧基功能化的共价有机框架和以戊二醛为交联剂的磁性金属有机框架载体制备的固定化酶,三者分别在pH为7.0~8.0、7.5~9.0、7.0~9.0的范围内能够保持50%以上的相对酶活,而本文中的固定化酶在更宽泛的pH范围内(pH为6.0~9.0)均能保持50%以上的相对酶活[44-46]。这可能是由于共价连接在反应过程中维持了脂肪酶的空间结构,使活性中心保持完整,从而增强了脂肪酶的pH稳定性,这与其他相关研究的结论类似[47-48]。
表 4 Lip-PDA-Cs-Fe3O4与其他研究中固定化酶pH稳定性的比较Table 4. Comparison of pH stability of Lip-PDA-Cs-Fe3O4 with previous publications for immobilized lipaseName pH range Ref. CRL-BSA-CELLAs 7.0-8.0 [44] PPL@COF 7.5-9.0 [45] Fe3O4-COOH@UiO-66-NH2@PPL 7.0-9.0 [46] Lip-PDA-Cs-Fe3O4 6.0-9.0 This work Notes:pH range is pH range in which the relative enzyme activity remains higher than 50%; BSA—Bovine albumin; CELLAs—Cross-linked enzyme aggregates; PPL—Porcine pancreatic lipase; COF—Covalent organic framework; Fe3O4-COOH—Carboxylic-functionalized magnetite; UiO-66-NH2—Zirconium aminobenzenedicarboxylate metal organic framework. 2.3.3 重复使用性
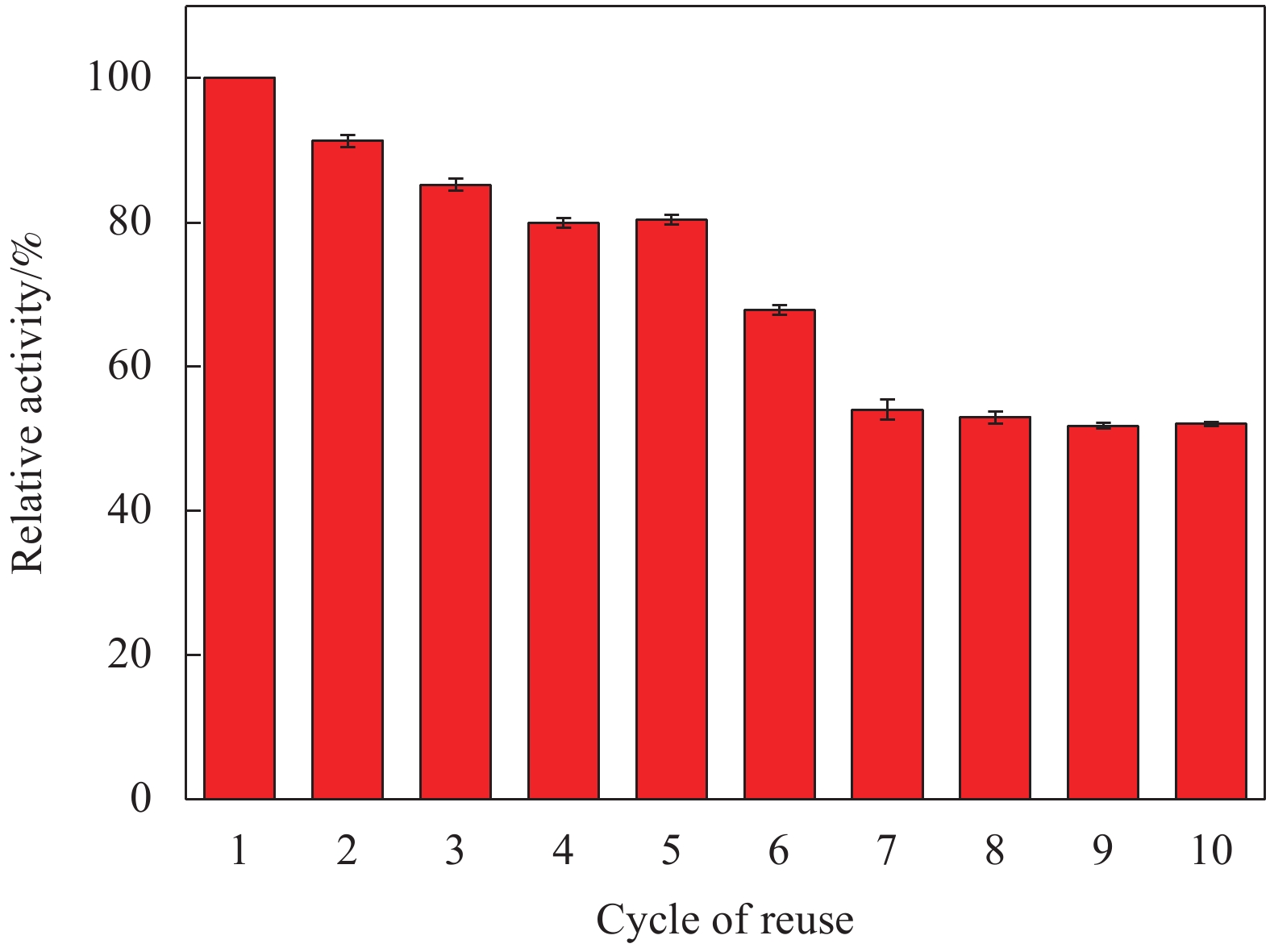
图13为Lip-PDA-Cs-Fe3O4经过10次循环后相对酶活的变化情况,重复使用性是衡量固定化酶应用价值的重要指标,重复使用性更好的固定化酶可以极大地降低酶制剂的使用成本[49]。在5次循环使用后,Lip-PDA-Cs-Fe3O4依然保持着80%以上的初始酶活,可能是由于在分离、洗涤、振荡、重复使用的过程中,机械力导致部分结合不稳固的酶蛋白从载体上脱落造成的[50]。而经过10次循环使用后,仍能保持52%的初始酶活,这可能主要是由于部分脂肪酶的活性中心反复与底物接触,造成了酶分子立体构象的变化,从而导致失活[28, 51-53]。王舒舒等[54]以双醛纤维素作为交联剂将褶皱假丝酵母脂肪酶固定在磁性壳聚糖复合材料上,经过5次循环后,能够保持初始酶活的75%,略低于本实验结果。
2.3.4 储藏稳定性
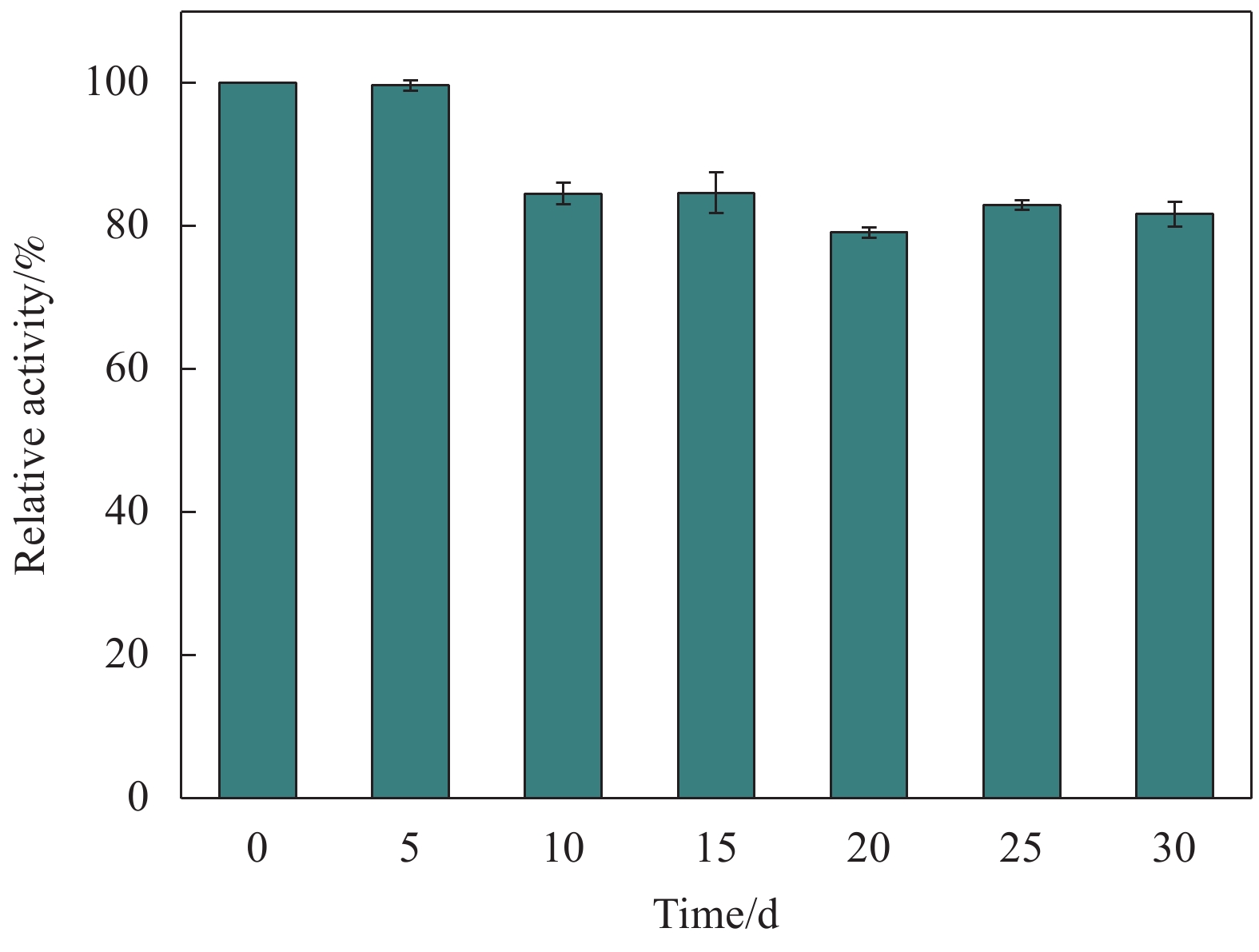
图14为Lip-PDA-Cs-Fe3O4储藏不同时间的酶活变化情况。结果表明,固定化酶储藏30 d后依然保持着82%的初始酶活,表现出了良好的储藏稳定性。苏丽访等[55]合成了一种聚多巴胺修饰的碳纤维复合材料用于固定南极假丝酵母脂肪酶,储藏9 d后,仅能保持初始活性的43%。Li等[39]以戊二醛为交联剂将假丝酵母脂肪酶固定在聚乙二醇修饰的聚乳酸载体表面,储藏30 d后能够保持70%的初始酶活。朱衡等[56]以聚乙二醇二缩水甘油醚为交联剂制备了一种环氧基功能化氨基树脂固定海洋假丝酵母脂肪酶,储藏30 d后能够保持初始酶活的70%左右。良好的储藏稳定性可能归因于脂肪酶与载体表面的基团发生了多点结合,从而稳定了酶分子的活性构象[28]。
2.3.5 酶促动力学
在评估固定化酶与游离酶的米氏常数的过程中,经拟合得到固定化酶与游离酶的Km分别为10.69 mg/mL和8.30 mg/mL,并且固定化后脂肪酶的Vmax值由
4300 U/mg下降至1421 U/mg。与游离酶相比,固定化酶的Km略有上升,反映出其与底物之间亲和力大小的变化,在固定化的过程中,由于脂肪酶的部分活性位点连接在载体表面,不能与底物结合,导致固定化酶对底物的亲和力较低,从而使酶活下降[48]。2.4 固定化酶在生产生物柴油中的应用
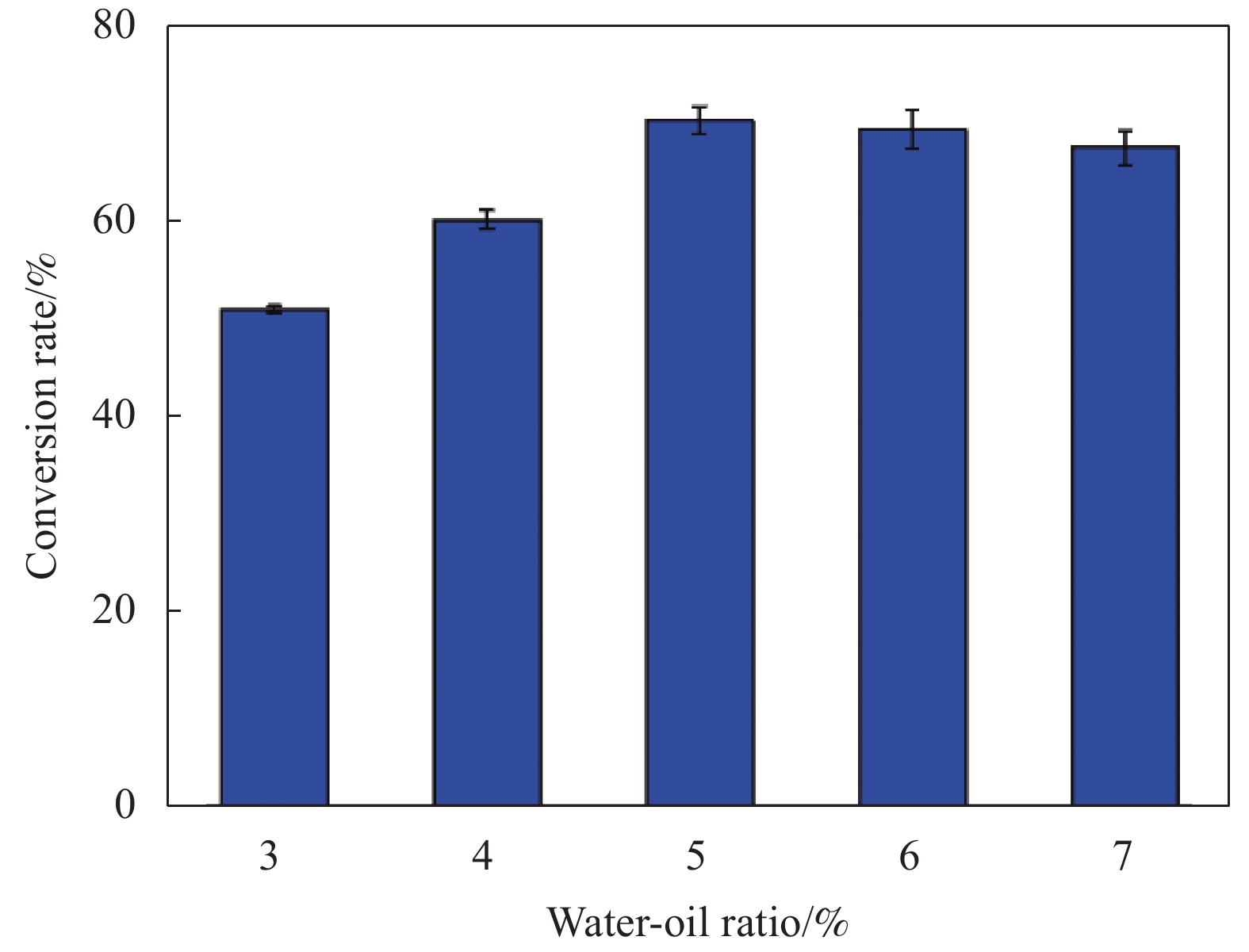
2.4.1 水油比对转化率的影响
图15为水油比对Lip-PDA-Cs-Fe3O4催化生物柴油转化的影响,可以观察到当水油比为3%时,生物柴油的转化率仅为51%,当水油比达到5%时,转化率增加至70%,当水油比继续增加至7%时,转化率下降至68%。这是由于脂肪酶具有作用于水相与有机相界面的特点,适当增加水含量可以增加酶与反应物接触的面积,从而提高转化率[57]。因此选择水油比为5%作为最佳转化条件。
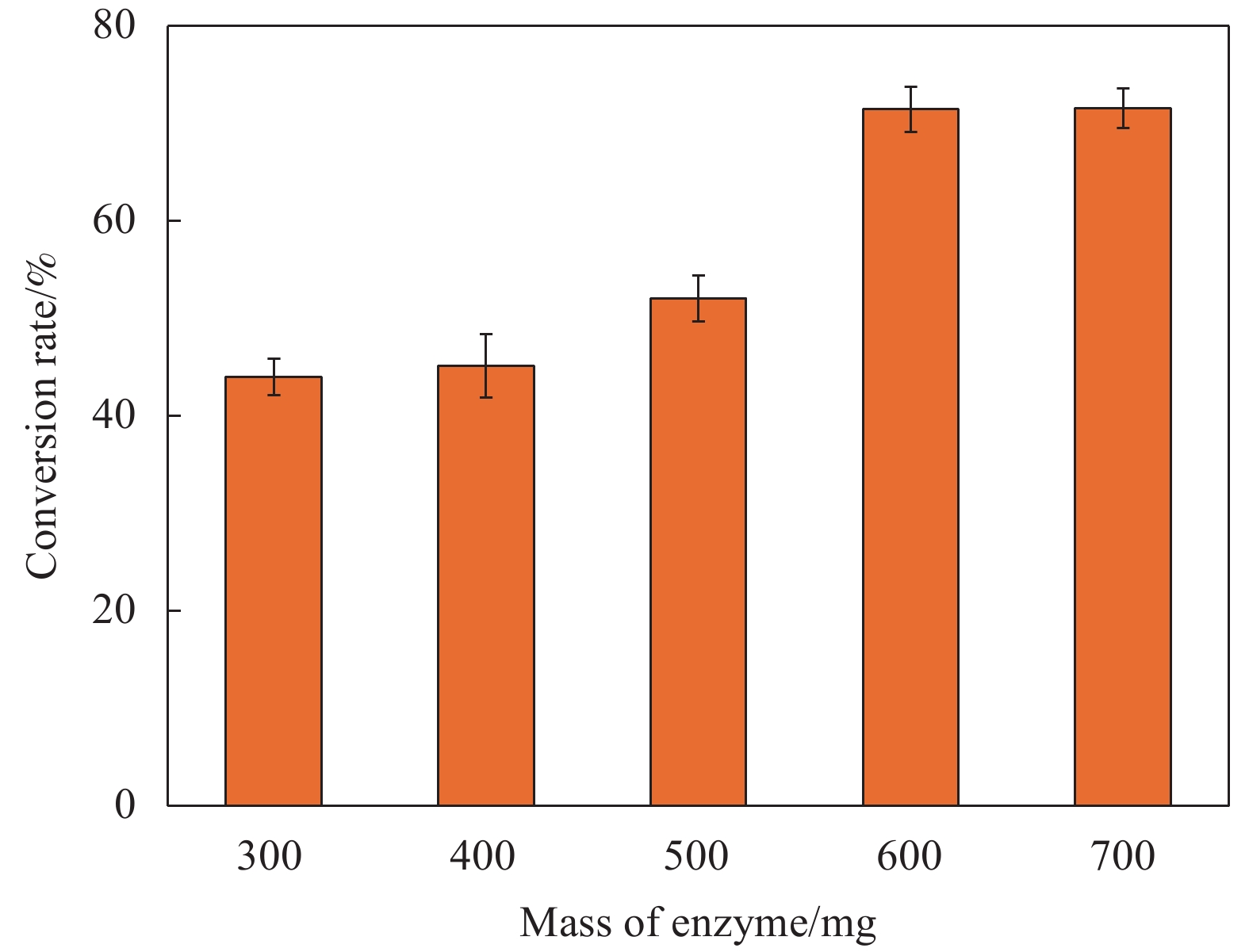
2.4.2 加酶量对转化率的影响
图16为加酶量对Lip-PDA-Cs-Fe3O4催化生物柴油转化的影响,由图可以看出随着加酶量逐渐增大,生物柴油的转化率呈现出明显的上升趋势,当加酶量达到600 mg时,转化率达到71%,而加酶量为700 mg时,转化率为72%。这种现象可能是由于反应体系中催化剂的量趋于饱和,继续增加催化剂会影响反应体系中反应物的传质[58]。因此在后续实验中,将600 mg作为较适宜的加酶量。
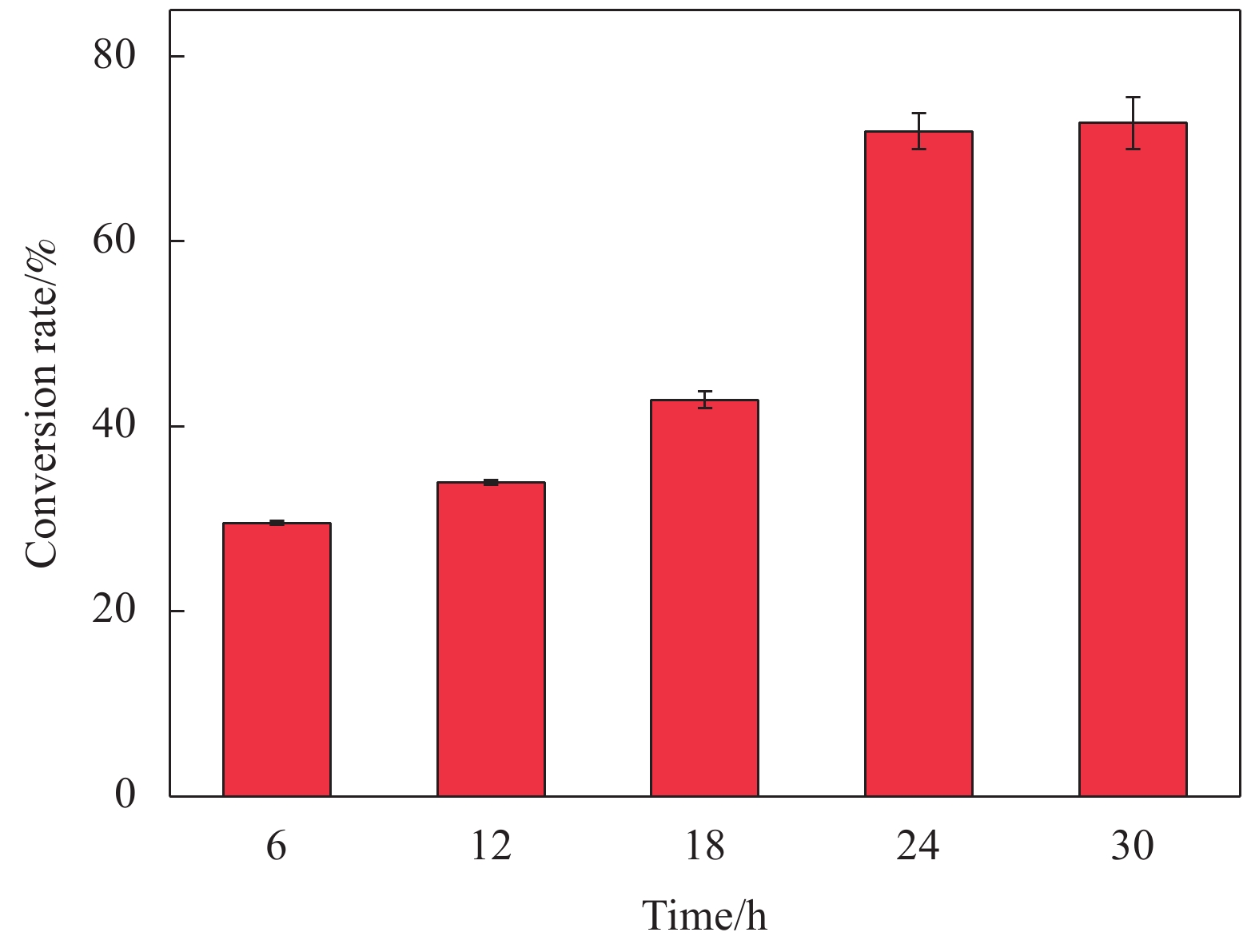
2.4.3 反应时间对转化率的影响
图17为反应时间对Lip-PDA-Cs-Fe3O4催化生物柴油转化率的影响,可以观察到转化率随反应时间的增加而逐渐增大,当反应时间为6 h时,转化率仅为30%,此时催化反应还未完全结束。当反应时间为24 h时,转化率为72%,而当催化反应进行到30 h时,转化率达到73%,证明此时催化反应趋近于平衡状态[59]。因此将24 h作为最佳转化反应时间。在相同条件下,反应时间为24 h时,游离酶的转化效率为54%,远低于固定化酶的转化率,证明固定化在一定程度上提高了酶的催化效率。Paluzar等[60]将脂肪酶固定在以戊二醛为交联剂活化的壳聚糖表面,同样应用于生物柴油的转化中,催化24 h时转化率约为65%。与贻贝仿生化学修饰相比,京尼平、戊二醛、环氧氯丙烷等传统交联剂在固定过程中会影响酶蛋白的结构,从而使酶蛋白失活[61-62]。在Mulinari等[63]的研究中,将脂肪酶分别固定在PDA修饰和戊二醛活化的氧化铝膜上,实验结果显示,PDA固定的酶水解活性高于经戊二醛处理的酶的水解活性,这可能是由于戊二醛表面的醛基影响了酶分子的蛋白构象造成的。
3. 结 论
(1)通过在磁性壳聚糖材料表面涂覆聚多巴胺涂层,制备了一种具有多孔结构的固定化载体,振动样品磁强计(VSM)数据表明该材料具有良好的超顺磁性和磁响应性。
(2)在对固定化条件进行优化后,确定最佳固定化温度为30℃,pH为6.0,初始酶浓度为5 mg/mL,固定化时间为5 h,经优化后固定化脂肪酶的最高酶活可达(
7392.91 ±121.22) U/g-载体。(3)在固定化酶的酶学性质研究中,得到最佳反应温度为50℃,最佳反应pH为7.0,热稳定性和pH稳定性均较强,拟合得到米氏常数Km和最大反应速度Vmax分别为10.69 mg/mL和
1421 U/mg。同时,固定化酶在5次循环后,能够保持80%以上的初始酶活,在10次循环使用后,固定化酶仍具有52%的初始酶活。(4)将固定化脂肪酶应用于生成生物柴油的实验中,在水油比为5%、加酶量为600 mg的条件下反应24 h,该固定化酶生产生物柴油的转化率可以达到72%,而此时游离脂肪酶的转化率仅为54%。相比于其他文献中的固定化酶,本文中的固定化酶具有可以快速分离、比表面积大、重复使用性高等优点,将为磁性多孔材料固定化酶的应用提供数据支持。
-
表 1 PDA-Cs-Fe3O4与Lip-PDA-Cs-Fe3O4的BET分析
Table 1 BET analysis of PDA-Cs-Fe3O4 and Lip-PDA-Cs-Fe3O4
Surface area/(m2·g−1) Pore volume/(mL·g−1) PDA-Cs-Fe3O4 106.8239 0.6028 Lip-PDA-Cs-Fe3O4 77.6027 0.4449 表 2 PDA-Cs-Fe3O4的孔径分析
Table 2 Pore size analysis of PDA-Cs-Fe3O4
Pore size/nm Pore volume/(mL·g−1) Percentage/% Micropore 0.35-2 0.0081 1.35 Mesopore 2-10 0.0589 9.84 10-50 0.2175 36.31 Macropore 50-120 0.3145 52.50 表 3 Lip-PDA-Cs-Fe3O4与其他研究中固定化酶热稳定性的比较
Table 3 Comparison of thermal stability of Lip-PDA-Cs-Fe3O4 with previous publications for immobilized lipase
Temperature/℃ Time/h Relative activity/% Ref. PEG/PLA/CRL 50 2 <70 [39] L-PHM3 4 <85 [40] PFL@EMMS 3 <80 [41] Lip-PDA-Cs-Fe3O4 6 90 This work Notes:Time is the duration of staying at 50℃; PEG—Polyethylene glycol; PLA—Polylactic acid; CRL—Candida rugosa lipase; L—Candida antarctica lipase; PHM—Polyacrylamide hydrogel microspheres; 3 is the concentration of phosphate buffer solution of lipase immobilized on polyacrylamide hydrogel microspheres; PFL—Pseudomonas fluorescens lipase; EMMS—Epoxy-functionalized macroporous and mesoporous SiO2. 表 4 Lip-PDA-Cs-Fe3O4与其他研究中固定化酶pH稳定性的比较
Table 4 Comparison of pH stability of Lip-PDA-Cs-Fe3O4 with previous publications for immobilized lipase
Name pH range Ref. CRL-BSA-CELLAs 7.0-8.0 [44] PPL@COF 7.5-9.0 [45] Fe3O4-COOH@UiO-66-NH2@PPL 7.0-9.0 [46] Lip-PDA-Cs-Fe3O4 6.0-9.0 This work Notes:pH range is pH range in which the relative enzyme activity remains higher than 50%; BSA—Bovine albumin; CELLAs—Cross-linked enzyme aggregates; PPL—Porcine pancreatic lipase; COF—Covalent organic framework; Fe3O4-COOH—Carboxylic-functionalized magnetite; UiO-66-NH2—Zirconium aminobenzenedicarboxylate metal organic framework. -
[1] 刘书成, 鲁海龙, 张林尚, 等. 酶在油脂制取、精炼与改性中的应用[J]. 中国油脂, 2023, 48(12): 31-39. LIU Shucheng, LU Hailong, ZHANG Linshang, et al. Application of enzymes in oil production, refining, and modification[J]. China Oils and Fats, 2023, 48(12): 31-39(in Chinese).
[2] 陈金行, 张逸, 张军涛, 等. 固定化脂肪酶的创制及其在乙酸肉桂酯无溶剂制备中的应用[J]. 生物技术通报, 2023, 39(9): 97-104. CHEN Jinxing, ZHANG Yi, ZHANG Juntao, et al. Preparation of immobilized lipase for the solvent-free synthesis of cinnamyl acetate[J]. Biotechnology Bulletin, 2023, 39(9): 97-104(in Chinese).
[3] 张永民. 纤维素链霉菌AU-10源脂肪酶—一种可应用于洗涤剂配方的酶[J]. 中国洗涤用品工业, 2020(7): 64-72. ZHANG Yongmin. Streptomyces cellulosus AU-10 source lipase—An enzyme that can be applied to detergent formulations[J]. China Cleaning Industry, 2020(7): 64-72(in Chinese).
[4] GAYATRIBEN B P, PARITA R, TORAL S, et al. Lipolytic nocardiopsis for reduction of pollution load in textile industry effluent and SWISS model for structural study of lipase[J]. Bioresource Technology, 2021, 341: 125673. DOI: 10.1016/j.biortech.2021.125673
[5] VERMA S, CHOUDHARY R N, KANADJE A P, et al. Diversifying arena of drug synthesis: In the realm of lipase mediated waves of biocatalysis[J]. Catalysts, 2021, 11(11): 1328. DOI: 10.3390/catal11111328
[6] KUMAR A, VERMA V, DUBEY V K, et al. Industrial applications of fungal lipases: A review[J]. Frontiers in Microbiology, 2023, 14: 1142536. DOI: 10.3389/fmicb.2023.1142536
[7] SAMUI A, CHOWDHURI A R, SAHU S K. Lipase immobilized metal-organic frameworks as remarkably biocatalyst for ester hydrolysis: A one step approach for lipase immobilization[J]. Chemistry Select, 2019, 4(13): 3745-3751.
[8] RIBEIRO E S, FARIAS B S, JUNIOR T R S A C, et al. Chitosan-based nanofibers for enzyme immobilization[J]. International Journal of Biological Macromolecules, 2021, 183: 1959-1970. DOI: 10.1016/j.ijbiomac.2021.05.214
[9] RODRIGUES R C, VIRGEN-ORTIZ J J, DOS S J C S, et al. Immobilization of lipases on hydrophobic supports: Immobilization mechanism, advantages, problems, and solutions[J]. Biotechnology Advances, 2019, 37(5): 746-770. DOI: 10.1016/j.biotechadv.2019.04.003
[10] 柳有财, 蔡俊. 羧基改性多孔磁性壳聚糖微球共固定化葡萄糖氧化酶与过氧化氢酶[J]. 功能材料, 2022, 53(2): 2146-2155. LIU Youcai, CAI Jun. Glucose oxidase and catalase co-immobilized by carboxyl modified porous magnetic chitosan microspheres[J]. Journal of Functional Materials, 2022, 53(2): 2146-2155(in Chinese).
[11] 毛梦雷, 孟令玎, 高蕊, 等. 多孔框架材料固定化酶研究进展[J]. 化工进展, 2023, 42(5): 2516-2535. MAO Menglei, MENG Lingding, GAO Rui, et al. Research progress on enzyme immobilization on porous framework materials[J]. Chemical Industry and Engineering Progress, 2023, 42(5): 2516-2535(in Chinese).
[12] 王曦琦, 刘梓钰, 梁晓云, 等. 聚多巴胺纳米材料及其在食品领域中的应用[J]. 食品工业科技, 2024, 45(5): 402-411. WANG Xiqi, LIU Ziyu, LIANG Xiaoyun, et al. Polydopamine nanomaterials and their applications in food field[J]. Science and Technology of Food Industry, 2024, 45(5): 402-411(in Chinese).
[13] ZHAO Y T, ZHANG K, ZENG J, et al. Immobilization on magnetic PVA/SA@Fe3O4 hydrogel beads enhances the activity and stability of neutral protease[J]. Enzyme and Microbial Technology, 2022, 157: 110017. DOI: 10.1016/j.enzmictec.2022.110017
[14] AMIN R, KHORSHIDI A, BENSCH W, et al. Degradation of sesame oil phenolics using magnetic immobilized laccase[J]. Catalysis Letters, 2020, 150: 3086-3095. DOI: 10.1007/s10562-020-03226-8
[15] 高丰琴, 王珊, 王云芳, 等. 磁性氧化石墨烯固定化氯过氧化物酶及其在奥酸性蓝45脱色中的应用[J]. 高等学校化学学报, 2018, 39(5): 904-910. GAO Fengqin, WANG Shan, WANG Yunfang, et al. Magnetic graphene oxide immobilized chloropperoxidase and its application in the decolorization of auroic acid blue 45[J]. Chemical Journal of Chinese Universities, 2018, 39(5): 904-910(in Chinese).
[16] 胡艺凡, 李正军, 刘长霞. 基于磁性Fe3O4粒子的固定化过氧化氢酶的制备及催化性质研究[J]. 北京化工大学学报(自然科学版), 2023, 50(2): 53-62. HU Yifan, LI Zhengjun, LIU Changxia. Preparation and catalytic properties of catalase immobilized on magnetic Fe3O4 particles[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2023, 50(2): 53-62(in Chinese).
[17] 邵文泰. 液体脂肪酶催化地沟油制备生物柴油的工艺优化[D]. 烟台: 烟台大学, 2023. SHAO Wentai. Optimization of biodiesel from gutter oil catalyzed by liquid lipase[D]. Yantai: Yantai University, 2023(in Chinese).
[18] 罗旭聪. 基于共价有机框架材料构建生物催化剂及性能研究[D]. 天津: 河北工业大学, 2020. LUO Xucong. Construction of biocatalyst based on covalent organic frame materials and the catalytic performance[D]. Tianjin: Hebei University of Technology, 2020(in Chinese).
[19] SUO H, GAO Z, XU L, et al. Synthesis of functional ionic liquid modified magnetic chitosan nanoparticles for porcine pancreatic lipase immobilization[J]. Materials Science and Engineering: C, 2019, 96: 356-364. DOI: 10.1016/j.msec.2018.11.041
[20] 王淑婧, 曾祥冰, 孙西同, 等. 贻贝仿生涂层修饰聚合物微球固定化脂肪酶的制备及应用[J]. 食品工业科技, 2024, 45(1): 108-117. WANG Shujing, ZENG Xiangbing, SUN Xitong, et al. Synthesis and application of lipase immobilized on mussel-inspired polymer microspheres[J]. Science and Technology of Food Industry, 2024, 45(1): 108-117(in Chinese).
[21] YANG X, CHEN Y, YAO S, et al. Preparation of immobilized lipase on magnetic nanoparticles dialdehyde starch[J]. Carbohydrate Polymers, 2019, 218: 324-332. DOI: 10.1016/j.carbpol.2019.05.012
[22] 包国庆, 吴纯鑫, 赵德明. 磁性Fe3O4纳米复合材料的制备及其对Pb(II)的吸附[J]. 复合材料学报, 2023, 40(1): 219-231. BAO Guoqing, WU Chunxin, ZHAO Deming. Preparation of magnetic Fe3O4 nanocomposites and their adsorption to Pb(II)[J]. Acta Materiae Compositae Sinica, 2023, 40(1): 219-231(in Chinese).
[23] BAI Y, WU W. The neutral protease immobilization: Physical characterization of sodium alginate-chitosan gel beads[J]. Applied Biochemistry and Biotechnology, 2022, 194(5): 2269-2283. DOI: 10.1007/s12010-021-03773-9
[24] QIN T, LIU L, CAO H, et al. Polydopamine modified cellulose nanocrystals (CNC) for efficient cellulase immobilization towards advanced bamboo fiber flexibility and tissue softness[J]. International Journal of Biological Macromolecules, 2023, 253(6): 126734.
[25] 铁伟伟, 邱帅彪, 王红霞, 等. Fe3O4/BiOBr/Graphene磁性气凝胶的构筑与Cr(Ⅵ)污水净化[J]. 复合材料学报, 2024, 41(4): 1987-1996. TIE Weiwei, QIU Shuaibiao, WANG Hongxia, et al. Construction of magnetic Fe3O4/BiOBr/Graphene aerogel and Cr(Ⅵ) wastewater purification[J]. Acta Materiae Compositae Sinica, 2024, 41(4): 1987-1996(in Chinese).
[26] 郭小华, 马剑琪. 磁性核壳结构Fe3O4@SiO2@TiO2-Au的制备及其光催化还原性能[J]. 复合材料学报, 2024, 41(10): 5340-5350. GUO Xiaohua, MA Jianqi. Fabrication of magnetic Fe3O4@SiO2@TiO2-Au with core-shell structure and its photocatalytic reduction activity[J]. Acta Materiae Compositae Sinica, 2024, 41(10): 5340-5350(in Chinese).
[27] 梁艳莉, 马剑琪, 郭少波. CoFe2O4@PDA@Pt核壳型磁性复合材料的制备及催化性能[J]. 复合材料学报, 2021, 38(5): 1551-1557. LIANG Yanli, MA Jianqi, GUO Shaobo. Preparation and catalytic properties of CoFe2O4@PDA@Pt magnetic composite with core shell structure[J]. Acta Materiae Compositae Sinica, 2021, 38(5): 1551-1557(in Chinese).
[28] CHENG W, LI Y, LI X, et al. Preparation and characterization of PDA/SiO2 nanofilm constructed macroporous monolith and its application in lipase immobilization[J]. Journal of the Taiwan Institute of Chemical Engineers, 2019, 104: 351-359. DOI: 10.1016/j.jtice.2019.09.013
[29] 闵丹, 彭川, 陈建, 等. 多孔纳米碳球的制备及其电化学性能研究[J]. 四川轻化工大学学报(自然科学版), 2020, 33(6): 6-11. MIN Dan, PENG Chuan, CHEN Jian, et al. Study on synthesis and electrochemical performance of porous carbon nano-spheres[J]. Journal of Sichuan University of Science & Engineering (Natural Science Edition), 2020, 33(6): 6-11(in Chinese).
[30] 李铃, 莫创荣, 邓冬祝, 等. La-Fe改性蛭石对水中磷酸盐的高效去除: 吸附行为及内在机制[J]. 复合材料学报, 2024, 41(10): 5412-5422. LI Ling, MO Chuangrong, DENG Dongzhu, et al. Performance and mechanism of La-Fe modified vermiculite adsorbent for efficient phosphorus removal[J]. Acta Materiae Compositae Sinica, 2024, 41(10): 5412-5422(in Chinese).
[31] 黄文涛, 邓呈逊, 吉宇尘, 等. 壳聚糖功能化磁性氧化石墨烯复合材料的制备及对甲基橙的吸附[J]. 复合材料学报, 2021, 38(4): 1262-1271. HUANG Wentao, DENG Chengxun, JI Yuchen, et al. Synthesis of chitosan functionalized magnetic graphene oxidecomposite and adsorption on methyl orange[J]. Acta Materiae Compositae Sinica, 2021, 38(4): 1262-1271(in Chinese).
[32] YIN Y, FEI X, TIAN J, et al. Synthesis of lipase-hydrogel microspheres and their application in deacidification of high-acid rice bran oil[J]. New Journal of Chemistry, 2022, 46(44): 21287-21300. DOI: 10.1039/D2NJ03761K
[33] BI Y, WANG Z, ZHANG R, et al. Improved catalytic properties of Thermomyces lanuginosus lipase immobilized onto newly fabricated polydopamine-functionalized magnetic Fe3O4 nanoparticles[J]. Processes, 2020, 8(5): 629. DOI: 10.3390/pr8050629
[34] GUO H, LEI B, YU J, et al. Immobilization of lipase by dialdehyde cellulose crosslinked magnetic nanoparticles[J]. International Journal of Biological Macromolecules, 2021, 185: 287-296. DOI: 10.1016/j.ijbiomac.2021.06.073
[35] 李薇, 石爱民, 焦博, 等. 乙酰化花生球蛋白载酶颗粒的制备及表征[J]. 生物技术进展, 2023, 13(5): 771-778. LI Wei, SHI Aimin, JIAO Bo, et al. Preparation technology and characterization of lipase immobilized with acetylated arachin nanoparticles[J]. Current Biotechnology, 2023, 13(5): 771-778(in Chinese).
[36] 徐然, 韩生华, 王利刚. 硅胶吸附-交联脂肪酶的研究[J]. 山西大同大学学报(自然科学版), 2021, 37(3): 7-11. XU Ran, HAN Shenghua, WANG Ligang. Study on the immobilization of lipase on silica gel by adsorption and cross-linking method[J]. Shanxi Datong University Journal (Natural Science Edition), 2021, 37(3): 7-11(in Chinese).
[37] 韩本勇, 周志梅, 耿树香, 等. 改性核桃壳固定化脂肪酶研究[J]. 江苏农业科学, 2020, 48(2): 282-286. HAN Benyong, ZHOU Zhimei, GENG Shuxiang, et al. Study of modified walnut shell immobilized lipase[J]. Jiangsu Agricultural Sciences, 2020, 48(2): 282-286(in Chinese).
[38] LYU J, LI Z, MEN J, et al. Covalent immobilization of Bacillus subtilis lipase A on Fe3O4 nanoparticles by aldehyde tag: An ideal immobilization with minimal chemical modification[J]. Process Biochemistry, 2019, 81: 63-69. DOI: 10.1016/j.procbio.2019.03.017
[39] LI S, ZHAO S, HOU Y, et al. Polylactic acid (PLA) modified by polyethylene glycol (PEG) for the immobilization of lipase[J]. Applied Biochemistry and Biotechnology, 2020, 190: 982-996. DOI: 10.1007/s12010-019-03134-7
[40] QIN Z, FENG N, LI Y, et al. Hydrogen-bonded lipase-hydrogel microspheres for esterification application[J]. Journal of Colloid and Interface Science, 2022, 606: 1229-1238. DOI: 10.1016/j.jcis.2021.08.147
[41] 张辉. 整体型大孔-介孔SiO2的制备及在固定化脂肪酶中的应用[D]. 宁波: 宁波大学, 2020. ZHANG Hui. Preparation of monolithic macroporous-mesoporous SiO2 and their application in lipase immobilization[D]. Ningbo: Ningbo University, 2020(in Chinese).
[42] WANG H, YUE W, ZHANG S, et al. Modification of silica xerogels with polydopamine for lipase B from Candida antarctica immobilization[J]. Catalysts, 2021, 11(12): 1463. DOI: 10.3390/catal11121463
[43] ACIKGOZ-ERKAYA I, BAYRAMOGLU G, AKBULUT A, et al. Immobilization of Candida rugosa lipase on magnetic biosilica particles: Hydrolysis and transesterification studies[J]. Biotechnology and Bioprocess Engineering, 2021, 26: 827-840. DOI: 10.1007/s12257-020-0387-9
[44] 闫妍. 磁性交联脂肪酶聚集体的制备及其催化植物甾醇酯化的研究[D]. 镇江: 江苏大学, 2022. YAN Yan. Preparation of magnetic cross-linked lipase aggregates and its catalytic esterification of phytosterols[D]. Zhenjiang: Jiangsu University, 2022(in Chinese).
[45] LIU X, WU J, YANG S, et al. Carboxy-functionalized covalent organic framework as a carrier for lipase immobilization and its application in inhibitors screening[J]. Applied Biochemistry and Biotechnology, 2024, 196: 4024-4037.
[46] XU J, CAO P, FAN Z, et al. Rapid screening of lipase inhibitors in scutellaria baicalensis by using porcine pancreatic lipase immobilized on magnetic core-shell metal-organic frameworks[J]. Molecules, 2022, 27(11): 3475. DOI: 10.3390/molecules27113475
[47] 张帆, 郑兰兰, 曹红, 等. 双重包埋激活脂肪酶内花凝胶微球的制备与表征[J]. 高等学校化学学报, 2023, 44(4): 108-116. ZHANG Fan, ZHENG Lanlan, CAO Hong, et al. Preparation and characterization of an inner flower gel microsphere double-embedded with the activated-lipase[J]. Chemical Journal of Chinese Universities, 2023, 44(4): 108-116(in Chinese).
[48] JI X, LI Y, WANG S, et al. Lipase/tannic acid magnetic hydrogel microspheres and their continuous catalytic application[J]. New Journal of Chemistry, 2023, 47(39): 18163-18172. DOI: 10.1039/D3NJ03268J
[49] ASMAT S, ANWER A H, HUSAIN Q. Immobilization of lipase onto novel constructed polydopamine grafted multiwalled carbon nanotube impregnated with magnetic cobalt and its application in synthesis of fruit flavours[J]. International Journal of Biological Macromolecules, 2019, 140: 484-495. DOI: 10.1016/j.ijbiomac.2019.08.086
[50] 陈进坤, 丁浩, 龙苋魏, 等. 猪胰脂肪酶固定化及连续流催化拆分合成(S)-2-四氢糠酸[J]. 发酵科技通讯, 2023, 52(3): 131-137. CHEN Jinkun, DING Hao, LONG Xianwei, et al. Immobilization of porcine pancreatic lipase and synthesis of (S)-2-tetrahydrofuroic acid by continuous flow catalytic splitting[J]. Bulletin of Fermentation Science and Technology, 2023, 52(3): 131-137(in Chinese).
[51] 孙周权. 多孔纤维素-壳聚糖微球载体的制备及其应用研究[D]. 上海: 东华大学, 2022. SUN Zhouquan. Preparation and application of porous cellulose-chitosan microsphere carrier[D]. Shanghai: Donghua University, 2022(in Chinese).
[52] 张锋. 纳米纤维素基固载材料制备及固定漆酶性能研究[D]. 哈尔滨: 东北林业大学, 2022. ZHANG Feng. Preparation of nanocellulose-based immobilized materials and study on the performance of its immobilized laccase[D]. Harbin: Northeast Forestry University, 2022(in Chinese).
[53] NEZHAD M K, AGHAEI H. Tosylated cloisite as a new heterofunctional carrier for covalent immobilization of lipase and its utilization for production of biodiesel from waste frying oil[J]. Renewable Energy, 2021, 164: 876-888. DOI: 10.1016/j.renene.2020.09.117
[54] 王舒舒, 王俞涵, 杨旭, 等. 磁性壳聚糖纳米复合材料固定化褶皱假丝酵母脂肪酶催化合成木质甾醇酯[J]. 精细化工, 2023, 40(1): 124-129. WANG Shushu, WANG Yuhan, YANG Xu, et al. Synthesis of lignosterol esters catalyzed by Candida rugosa lipase immobilized on magnetic nanocomposites[J]. Fine Chemicals, 2023, 40(1): 124-129(in Chinese).
[55] 苏丽访, 王翠娥, 蔡再生, 等. 聚多巴胺改性自支撑碳纤维固定化酶研究[J]. 国际纺织导报, 2020, 48(8): 32-36, 46. SU Lifang, WANG Cui'e, CAI Zaisheng, et al. Study on immobilized enzyme of polydopamine modified self-supporting carbon fiber[J]. Melliand China, 2020, 48(8): 32-36, 46(in Chinese).
[56] 朱衡, 张继福, 张云, 等. 环氧交联剂和氨基载体固定化海洋假丝酵母脂肪酶[J]. 中国生物工程杂志, 2020, 40(5): 57-68. ZHU Heng, ZHANG Jifu, ZHANG Yun, et al. Immobilization of marine candida lipase using novel epoxy cross-linker and amino carrier[J]. China Biotechnology, 2020, 40(5): 57-68(in Chinese).
[57] BINHAYEEDING N, KLOMKLAO S, PRASERTSAN P, et al. Improvement of biodiesel production using waste cooking oil and applying single and mixed immobilised lipases on polyhydroxyalkanoate[J]. Renewable Energy, 2020, 162: 1819-1827. DOI: 10.1016/j.renene.2020.10.009
[58] 苗长林, 吕鹏梅, 李志兵, 等. 生物质结渣固体碱催化剂制备生物柴油[J]. 太阳能学报, 2022, 43(2): 33-39. MIAO Changlin, LYU Pengmei, LI Zhibing, et al. Preparation of biodiesel using biomass slagging as solid base catalyst[J]. Acta Energiae Solaris Sinica, 2022, 43(2): 33-39(in Chinese).
[59] 黄振旭, 裴先茹, 李雨晴, 等. 大豆油制备生物柴油K2CO3/SiO2固体碱催化剂性能研究[J]. 山东化工, 2023, 52(6): 9-12. HUANG Zhenxu, PEI Xianru, LI Yuqing, et al. Performance study on the preparation of biodiesel K2CO3/SiO2 solid alkali catalyst from soybean oil[J]. Shandong Chemical Industry, 2023, 52(6): 9-12(in Chinese).
[60] PALUZAR H. Production of high quality biodiesel from sunflower soapstock acid oil as novel feedstock: Catalyzed by immobilized pancreatic lipase[J]. Journal of the American Oil Chemists' Society, 2024, 101: 251-265.
[61] FAN X, ZHANG P, TENG S, et al. Recent research on lipase immobilization with multipoint covalent treatment by glutaraldehyde[J]. Current Organic Chemistry, 2023, 27(4): 248-259. DOI: 10.2174/1385272827666230417084200
[62] 毕艳红. 磁性纳米材料固定化脂肪酶及其催化性能研究[D]. 无锡: 江南大学, 2020. BI Yanhong. Preparation and the catalytic performance of lipase immoblized on magnetic nanoparticles[D]. Wuxi: Jiangnan University, 2020(in Chinese).
[63] MULINARI J, AMBROSI A, DE MELLO INNOCENTINI M D, et al. Lipase immobilization on alumina membranes using a traditional and a nature-inspired method for active degradation of oil fouling[J]. Separation and Purification Technology, 2022, 287: 120527. DOI: 10.1016/j.seppur.2022.120527
-
目的
脂肪酶作为一种高底物特异性的绿色催化剂,广泛应用于生物能源、食品加工、药物合成等行业中,对游离酶进行固定化,不仅能够增强酶在不同条件下的稳定性,同时还有利于实现酶制剂的重复利用,更重要的是,还能有效降低酶催化剂在实际应用中的成本。
方法以磁性纳米颗粒为核,结合贻贝仿生技术,在表面涂覆壳聚糖与聚多巴胺涂层,制备了一种具有优异孔隙结构的复合材料。利用涂层与酶分子之间的共价键、氢键等作用力进行酶的固定化,并进行一系列表征分析,优化固定化工艺并对酶学性质进行研究。在此基础上,将固定化酶应用于生物柴油的催化生产,为固定化酶的实际应用提供数据支持。
结果透射电镜图显示制备的磁性颗粒粒径在10-20 nm之间,由红外光谱可以观察到载体表面成功涂覆聚多巴胺涂层。XRD数据显示载体具有典型的单相FeO尖晶石结构,表明修饰过程并未改变磁性颗粒的晶体结构。VSM数据显示FeO颗粒与Lip-PDA-Cs-FeO的最大饱和磁化强度分别为69.793 emu/g与27.02 emu/g,具有超顺磁性,且在外加磁场条件下,固定化酶能够在40 s内实现快速分离,BET分析显示固定化酶具有较大的比表面积和孔容积,PDA-Cs-FeO的比表面积为106.8239 m/g,孔体积为0.6028 mL/g,具有大孔和介孔结构,能够为脂肪酶提供更多的结合位点。优化得到的固定化工艺为:温度为30 ℃,pH为6.0,时间为5 h,初始酶浓度为5 mg/mL,在对固定化酶的酶学性质的研究中,得到最佳反应温度为50 ℃,最佳反应pH为7.0,热稳定性和pH稳定性均较强,固定化酶在5次循环后,能够保持80%以上的初始酶活,在10次循环使用后,固定化酶仍能保持52%的初始酶活。将固定化脂肪酶应用于催化生产生物柴油的实验中,在水油比为5%,加酶量为600 mg的条件下反应24 h,该固定化酶生产生物柴油的转化率可以达到72%,而游离脂肪酶的转化率仅为54%,表明固定化酶具有良好的催化能力。
结论成功制备贻贝仿生功能化多孔磁性载体,具有优异的孔结构和良好的超顺磁性,其表面具有丰富的基团可实现无交联剂条件下直接固定化脂肪酶。固定化酶的温度耐受性与pH耐受性均得到提高,载体与酶之间的氢键、共价键等多种作用力能够起到稳定蛋白构象的作用。同时,固定化酶也具有良好的重复使用性,并能用于生物柴油的催化生产。





 下载:
下载: