Preparation and antibacterial properties of ZnFe2O4@polydopamine@Ag nanocomposites
-
摘要: 随着生活质量的提高,抗生素已成为人类不可或缺的药物,但近年来抗生素的滥用导致大量耐药菌出现对社会健康造成了严重的威胁。因此,迫切需要开发新型、有效持久的抗菌剂,以应对日益增长的公共卫生需求。本文先以FeCl3、NaAc和ZnCl2为原料用“热溶剂法”制备磁性铁酸锌(ZnFe2O4),再以ZnFe2O4为核进行聚多巴胺(PDA)包覆形成ZnFe2O4@PDA纳米微球,最后将由化学还原法制备的粒径在2~16 nm的银纳米颗粒(Ag NPs)负载于ZnFe2O4@PDA表面,形成ZnFe2O4@PDA@Ag纳米复合材料。通过TEM、XRD、XPS、UV-Vis、FTIR、Zeta电位等表征材料形貌特征。以革兰氏阴性菌铜绿假单胞菌(P. aeruginosa)、革兰氏阳性菌金黄色葡萄球菌(S. aureus)和耐药菌沙门氏菌(T-Salmonella)为模式菌,研究ZnFe2O4@PDA@Ag材料的抑菌活性及抑菌机制。实验结果表明,相比于同比例浓度的Ag NPs (负载量0.39%),材料对P. aeruginosa的抑菌率提升了57.1%、对S. aureus和T-Salmonella提升值分别为61.7%和39.2%。材料浓度为200 μg/mL,作用时间60 min条件下,ZnFe2O4@PDA@Ag对测试菌抑制率均可达到99.9%。抑菌机制结果证实,ZnFe2O4@PDA@Ag可与细胞壁表面蛋白作用破坏细胞壁,进入细菌内部与胞内蛋白和相关酶作用阻碍细胞呼吸,且破坏DNA结构并抑制其复制过程,从而影响细菌呼吸和细胞分裂等生理生化过程,最终导致细菌死亡。该材料以磁性ZnFe2O4为内核,具有可重复利用、高性价比、无二次污染等优点;PDA层包覆使材料具有良好的生物相容性。同时,Ag NPs在ZnFe2O4@PDA纳米微球表面的负载,解决了Ag NPs易团聚问题,且因小颗粒Ag NPs可直接通过离子通道进入细菌内部,使ZnFe2O4@PDA@Ag具备了优异的抗菌活性。本工作可为新型、智能化抗生素材料的研发提供理论依据。
-
关键词:
- ZnFe2O4@聚多巴胺(PDA)@Ag /
- 纳米材料 /
- 抑菌机制 /
- 抑菌材料 /
- Ag纳米颗粒(NPs)
Abstract: With the improvement of life quality, antibiotics have become indispensable drugs for human beings. However, the prevalence of multiple super pathogenic bacteria in environments are induced by the extensive use of antibiotics, which poses a serious threat to social health. It has become extremely urgent to develop new, effective and durable antibacterial agents in response to a rising publichealth demand. In this paper, magnetic zinc ferrite (ZnFe2O4) was prepared by one-pot method using FeCl3, NaAc and ZnCl2 as raw materials. Secondly, ZnFe2O4@PDA nanospheres were formed by coating polydopamine (PDA) on the surface of ZnFe2O4. Finally, silver nanoparticles (Ag NPs) with particle size of 2-16 nm prepared by chemical reduction method were adsorbed on the surface of ZnFe2O4@PDA nanospheres to form ZnFe2O4@PDA@Ag nanocomposites. The prepared nanocomposite was characterized by TEM, XRD, XPS, UV-Vis, FTIR and Zeta potential. The antimicrobial activity and mechanism of ZnFe2O4@PDA@Ag were studied with gram-negative bacteria P. eruginosa, gram-positive bacteria S. aureus and drug-resistant bacteria T-Salmonella. Compared with the same concentration of Ag NPs (loading 0.39%), the antibacterial rate of the material against P. aeruginosa was increased by 57.1%, and that against S. aureus and T-Salmonella was increased by 61.7% and 39.2%, respectively. When tested bacterial were treated for 60 min in 200 μg/mL ZnFe2O4@PDA@Ag, the inhibition rates of the material to the three test bacteria reached 99.9%. The results of bacteriostasis mechanism showed that ZnFe2O4@PDA@Ag could interact with cell wall surface proteins to destroy cell wall, enter the interior of bacterial and interact with intracellular proteins and related enzymes to hinder cell respiration, damage DNA structure, and inhibit its replication process, thus affecting physiological and biochemical processes such as bacterial respiration and cell division, and eventually lead to bacterial death. With magnetic ZnFe2O4 as the core, the nanocomposite is of repeatable utilization, high ratio performance and price, no second pollution. And the coating of PDA layer makes the nanocomposite has good biocompatibility. Importantly, the ZnFe2O4@PDA@Ag not only solves the problem of Ag NPs being easy to agglomerate, but also has high antibacterial activity because small particles of Ag NPs can directly enter bacteria through ion channels. This study provides a theoretical basis for research and development of new and intelligent antibiotic materials. -
碳纤维增强树脂复合材料(Carbon fiber reinforced plastics,CFRP)具有比金属更高的比刚度和比强度、优异的耐腐蚀和抗疲劳特性,但是其面外承载能力及抗冲击特性较弱[1-3],而金属延展性较好,抗冲击性能优良。为了结合二者的优点,常常将金属与CFRP复合材料复合,进行轻量化结构设计,如纤维-金属层合板(Fiber metal laminates, FMLs)超混杂结构[1,4],纤维-金属-泡沫夹层结构[5-7]等在航空航天、汽车工业、船舶和民用建设等领域的应用越来越广泛[8-16]。就汽车轻量化而言,发展车用CFRP-金属超混杂层合承载结构是一种既能满足高性能要求又同时兼顾一定成本的策略。在金属方面,单从材料的密度来看,铝合金、钛合金及镁合金等轻金属相比于钢的密度较小,但其更高的成本也在一定程度上限制了其在汽车轻量化方面的应用[17];而热成型钢因其成本较低、强度较高、碰撞吸能优良及成型性较好等优势已成为汽车轻量化的一种主要材料[18]。因此结合CFRP复合材料与热成型钢的优点,开发CFRP-热成型钢超混杂层合承载结构,在汽车工业具有非常良好的应用前景,目前宝马7系的B柱结构已经采用了这种混杂轻量化结构设计。然而,热成型钢和CFRP复合材料属于异种材料,两者之间必然存在物理性能的差异(如热膨胀系数、弹性模量等),导致钢与CFRP复合材料界面之间粘结强度较低,从而在界面上容易产生脱层,滋生裂纹。因此,对钢与CFRP复合材料界面连接进行增强增韧研究十分重要。
就改善FMLs层间断裂韧性而言,可以从两个方面分别入手:(1)可以通过改进金属与CFRP复合材料界面性能实现改善其层间断裂韧性的目的;(2)可以通过提高CFRP复合材料层的力学性能来改善其层间断裂韧性。对于改进FMLs界面性能,一般要对金属进行表面处理,如机械打磨[19]、激光刻蚀[20]、硅烷化处理[21]、喷砂[22-23]和等离子处理[24]等。对于改进CFRP复合材料层间力学性能,插层[25-27]、三维编织[28]、z-pinning[29]等技术被开发出来。目前,大部分学者的研究主要集中在金属表面处理方式或CFRP复合材料内部插层,而结合金属表面处理技术和CFRP-金属界面插层协同改善FMLs层间断裂韧性的研究还较少,对其增韧机制的研究还不够完善。
本文以热成型钢和CFRP复合材料为研究对象,采用金属表面处理和界面插层协同增韧方案,运用热压成型工艺制备出了6种不同界面强韧化方案的CFRP-热成型钢超混杂复合结构。并通过双悬臂梁试验(Double cantilever beam tests, DCB)和相关表征,讨论了表面处理和界面插层对CFRP-热成型钢超混杂复合结构层间断裂韧性的影响。另外,基于内聚区模型,对典型的界面增韧方案进行建模,并将其与实验结果进行了对比。
1. 试验方案
1.1 原材料
试验采用的钢板为连续变截面轧制热成型钢板(Tailor rolled blanks, TRB),厚度为1.2 mm,由北汽集团新技术研究院提供,其主要化学成分(按质量分数计算)为0.23wt%C、0.25wt%Si、1.35wt%Mn、0.19wt%Cr、0.04wt%Mo, 0.003wt%B, 经过加热并淬火后的拉伸强度可达1 500 MPa;单向T700碳纤维/树脂预浸料,中复神鹰碳纤维有限公司;环氧树脂(Epoxy,EP)为双酚F型树脂EPON 862,固化剂为EPIKURE 3140,均由广州市镐韵化工有限公司提供,其中环氧树脂与固化剂的质量比为2∶1;胶膜为艾联公司的L-F501,厚度约为0.3 mm;具体的材料参数见表1。其他原材料均由成都科隆化工有限公司提供。
表 1 碳纤维增强树脂复合材料(CFRP)及插层(L-F501胶膜和树脂)的物理参数Table 1. Physical parameters of carbon fiber reinforced plastics(CFRP) composite and interlayer (L-F501 and epoxy)Material Physical parameter Value CFRP Young’s modulus (Fiber direction)/GPa 138 Young’s modulus (Transverse direction)/GPa 10 Tensile strength (Fiber direction)/MPa 1 800 Class fiber volume fraction/vol% 67 L-F501 Young’s modulus/GPa 3.6 Tensile strength/MPa 40 Steel-to-steel joint (Untreated)/MPa 28 Epoxy Young’s modulus/GPa 3 Tensile strength/MPa 60 1.2 超混杂层合板制备流程
本文采用热压成型工艺,对CFRP和热成型钢进行有效地共固化粘结。具体制备CFRP-热成型钢超混杂层合板的流程和热压工艺如图1所示。
1.3 界面强韧化方案
1.3.1 金属表面脱脂处理
裁剪一定尺寸的热成型钢板,将其浸泡至酒精溶液中,超声清洗30 min,以做简单的脱脂处理,60℃干燥箱烘干。最后裁剪相应尺寸的CFRP复合材料预浸料,与热成型钢进行共固化热压成型。
1.3.2 金属表面打磨处理
选用600#型号砂纸对热成型钢表面进行有效打磨,随后将打磨处理后的钢板浸泡至酒精溶液中进行脱脂,其余过程同1.3.1节。
1.3.3 金属表面喷砂处理
选用36#金刚砂(SiC类型),利用吸入式喷砂机对热成型钢进行喷砂处理,喷砂作业时空气压力为0.8 MPa左右,喷砂距离约为9 cm,喷砂角度为70°~85°,随后将喷砂处理后的钢板浸泡至酒精溶液中,超声清洗30 min,以去除表面的油脂和残留的SiC颗粒,其余过程同1.3.1节。
1.3.4 界面插层处理
由于CFRP复合材料与金属之间容易存在电化学腐蚀问题,因此引入界面插层来隔绝电化学腐蚀。本文拟采用L-F501胶膜和纯树脂插层两种方案。
L-F501胶膜插层:直接将裁剪好的单层胶膜引入到CFRP复合材料与金属界面之间,进行叠层铺设,最后将试件放到热压机中,进行共固化热压成型(最终胶膜的厚度在0.2 mm左右)。
纯树脂插层:首先将环氧树脂与固化剂按质量2∶1进行混合,进行搅拌10 min,脱泡5 min,得到自制的纯树脂粘结剂。采用涂布机将配好的纯树脂粘结剂均匀敷在热成型钢与裁好的CFRP复合材料之间,保证环氧胶面密度为225 g/m2,最后将试件放到热压机中,进行共固化热压成型(最终的环氧胶厚度在30 μm左右)。
对上述金属表面处理方式和界面插层进行组合,得到了本文层间增韧的具体6种方案如表2所示。
表 2 试验方案Table 2. Experimental schemesGroup Scheme name Abbreviation scheme 1 Degreasing Degreasing 2 600# sandpaper grinding 600# 3 Sandblasting GB36# 4 Degreasing/adhesive film interleaves Degreasing/AF 5 Sandblasting/adhesive film interleaves GB36#/AF 6 Sandblasting/epoxy resin interleaves GB36#/EP 1.4 试验加载与测试
参照标准JIS K 7086[30]对CFRP-热成型钢超混杂层合板进行DCB实验,本文中的层合板结构为2/1结构(铺叠形式为钢/
[0∘]3 CFRP/钢)。由于试件不完全对称,在DCB测试中可能造成试件末端偏移影响测量精度[31],为此通过增大钢板厚度和减小CFRP复合材料层的厚度来近似使其上下板的弯曲刚度接近,以减小实验误差。试件尺寸及加载示意图如图2所示。其中,L、B、2H、t分别代表试件的长、宽、高和CFRP复合材料层的厚度。预制裂纹长度为af ;嵌入物尖端至力的加载点为初始裂纹,其初始分层长度为a ;分层增量Δa 由钢板两侧的刻度作为标记。实验的加载速度为1 mm/min,当分层增量达到50 mm时,停止加载。采用改进的柔度校准方法计算得到I型层间断裂韧性GIC (kJ/m2)[30]:GIC=32(2H)(PCB)(Bλ)23αI (1) a2H=αI(Bλ)13+α0 (2) 其中:
PC 为裂纹起始时的临界载荷;λ 为柔度;αI 为拟合直线的截距;α0 为拟合直线的斜率。2. 结果与讨论
2.1 CFRP-热成型钢超混杂层合板双悬臂梁实验测试结果
图3为通过静态DCB试验得到的各类型试件的I型载荷-位移曲线。可知:随着张开位移的增大,载荷也逐渐增大,载荷与张开位移初始阶段呈线性关系;随后曲线出现拐点,载荷非线性上升直到最大值;最后阶段,张开位移增大,载荷
P 逐渐减小,直到分层长度达到50 mm,结束实验。图4为所有方案试件的临界载荷PC 。可以看到,金属表面处理和界面插层对界面失效临界载荷PC 有着不同的影响。其中,对金属表面进行喷砂处理可以有效地提高临界载荷PC ,且效果明显优于其他类别的表面处理方式;对热成型钢和CFRP复合材料界面进行插层,如脱脂/界面插层胶膜试件,相比于单进行脱脂处理试件,其临界载荷PC 也得到了极大的提高,表明界面插层有利于层间力学性能的提高;在对金属表面进行喷砂处理的基础上,进一步在异种材料界面引入插层进行协同增强处理,如喷砂/界面胶膜插层试件,其临界载荷PC 相比于脱脂/界面胶膜插层试件有了更进一步地提高,证明了采用金属表面处理技术与界面插层协同改性层合板的有效性。其可以最大幅度地提高界面失效临界载荷。另外,对于协同改性层合板的试件,临界载荷值PC 均高于只进行金属表面处理的试件;纯树脂插层试件的临界载荷低于胶膜插层的临界载荷。通过载荷、张开位移和分层增量可以计算出不同位置处的断裂韧性值。图5为不同方案试件的R曲线,横坐标为分层增量Δα,纵坐标为I型层间断裂韧性。可以看出,随着裂纹的扩展,其层间断裂韧性值逐渐增大,主要是由于初始分层裂纹形成后会引起纤维桥接,随后层间断裂韧性趋于平稳状态。
不同方案对应的I型断裂韧性
GIC 和断裂阻抗GIR 如图6所示,其中GIC 为Δα=0 mm处的断裂韧性值,GIR 为Δα=25~45 mm处的平均断裂韧性值。可以看出,断裂韧性的变化规律与临界载荷的变化规律相同。其中,对于机械打磨的试件,GIC 和GIR 均比较低;喷砂试件的GIC 和GIR 均高于脱脂试件,分别提高了64%和81%(见图6),说明喷砂处理可以有效提高层间断裂韧性;在脱脂钢板与CFRP复合材料界面之间引入胶膜,其断裂韧性得到了极大的提高,相比于脱脂试件,GIC 和GIR 分别提高了214%和237%;对CFRP复合材料-热成型钢进行喷砂和界面胶膜插层协同改性,可以最大限度地提高层间断裂韧性,尤其GIC ,相比于脱脂试件提高了近343%,相比于喷砂试件提高了170%,相比脱脂/界面插层胶膜试件提高了41%;另外,纯树脂插层的试件,其层间断裂韧性相比于只进行金属表面处理的试件也有较大提高。2.2 CFRP-热成型钢超混杂层合板I型裂纹扩展有限元模拟
利用ABAQUS软件对层合板I型裂纹扩展进行有限元模拟。其中,CFRP复合材料和钢板采用二维平面应变单元,单元类型为CPE4RH。胶膜或纯树脂插层采用二维平面应变单元,单元类型为内聚单元COH2D4。由于胶膜固化后有实际厚度且不可忽略,因此对Degreasing/AF 和GB36#/AF样品采用有限厚度内聚单元建模来模拟界面脱粘;而其他类型试件,界面胶层较薄,故采用零厚度内聚单元进行建模。在模拟裂纹扩展阶段时,为了克服计算收敛问题,将内聚单元尺寸调到0.5 mm以下。最后根据试验测得的I型断裂韧性
GIC 等相关参数,得到I型加载模拟结果,并将其与实验结果进行对比,如图7所示,可见,计算结果和试验结果吻合程度较好。2.3 CFRP-热成型钢超混杂层合板界面增韧机制
有多种因素促成了CFRP-热成型钢超混杂层合板层间断裂韧性的提高。其中,钢板表面的物理化学性质(如钢板表面的微结构、粗糙度和表面润湿性等)起着重要的作用。
图8为不同金属表面处理方式下的钢板表面形貌。对脱脂钢板表面进行扫描电镜观察(见图8(a)),明显可见脱脂钢板表面有很多不规则的凹凸结构,相对粗糙;而钢板经过砂纸打磨处理之后(见图8(b)),原本粗糙的表面变得更光滑,表面出现了一些较细腻的划痕;对钢板表面进行喷砂处理后(见图8(c)),钢板表面出现了较大的起伏,相较脱脂钢板,其表现变得更粗糙,凹凸结构也更明显。从上述钢板表面微结构的变化可以看出,不同的表面处理方式可以得到不同的粗糙度和微结构,它们是影响层间断裂韧性的一个重要因素。图9为采用激光共聚焦扫描显微镜测试得到的钢板表面粗糙度。其中脱脂钢板表面的粗糙度
Ra 为2.55 μm,砂纸打磨处理后的钢板表面的粗糙度为0.79 μm,喷砂钢板表面的粗糙度为7.97 μm。粗糙度测试结果与SEM结果一致,同时也与相应金属表面处理试件的层间断裂韧性值的大小相互吻合,表现为粗糙程度越高,其层间断裂韧性也越大,这是由于粗糙的表面有利于提高金属与树脂之间的力学机械联锁作用,从而在一定程度上改善超混杂层合板的层间断裂韧性。图10为不同金属表面处理方式下钢板表面的接触角。可以得出以下结论:对脱脂钢板进行机械打磨,由于表面的凹凸结构被破坏,钢板表面的接触角从
77.5∘ 降到72.5∘ ,润湿性增强;喷砂处理的钢板,表面接触角较大,浸润性也较差,不利于树脂与金属之间的充分接触[17]。但从最终的DCB实验结果来看,虽然表面润湿性和粗糙度都对界面粘结性能有影响,但是两者存在竞争机制,本实验中,表面粗糙度对层间断裂韧性的提升占主导地位。图11为采用电子显微镜观察到的各组试件的钢板一侧破坏面。从图11(a)和图11(b)可以看到,对于脱脂试件和砂纸打磨的试件,其钢板表面只有微量的碳纤维和树脂附着,CFRP复合材料与热成型钢直接在界面发生失效,裂纹扩展时裂纹几乎不发生偏转(见图12(a)),导致其层间断裂韧性较低。当对热成型钢表面进行喷砂处理之后,如图11(c)GB36#样品,由于提高了热成型钢与树脂之间的机械联锁作用,界面脱粘的现象发生了改变,大量的纤维和树脂附着在钢板表面,界面破坏形式主要为内聚破坏,而内聚破坏主要由高分子基体失效引起,在裂纹扩展时会消耗更多的能量,因此GB36#样品的层间断裂韧性较脱脂和机械打磨试件要高,同时这也证明了改变界面破坏的形式,可以有效地提高金属纤维层合板的层间断裂韧性。进一步对GB36#试件破坏面的局部进行显微镜观察(见图11(c)右上角),可以看到有少部分的钢板直接暴露了出来,可能原因是喷砂会使钢板表面粗糙度急剧增加,润湿性下降,导致部分钢板与树脂粘接作用力不强而脱粘。如图11(e),在脱脂钢板与CFRP复合材料界面之间引入胶膜,其破坏模式比较特殊,除了裂纹起始这一小部分的破坏模式是界面失效外,其他区域均是内聚失效;而且可以清楚地看到破坏面比较粗糙同时伴有胶层中短切纤维拔出的现象,粗糙的表面说明了裂纹在扩展时,由于裂纹偏转和基体的塑性变形产生了更大的断裂面积,而纤维的桥接作用又有利于胶膜的增强增韧;另外胶膜与复合材料之间存在化学交联的作用,界面粘结性能较好,以上就是插层胶膜能够大幅度提高层间断裂韧性的主要原因。将Degreasing/AF和GB36#/AF试件进行对比(见图11(e)和图11(f)),GB36#/AF试件的钢板表面全部被断裂的胶膜所包覆,它在起裂和裂纹扩展位置的破坏模式都属于内聚破坏,而Degreasing/AF试件在起裂和裂纹扩展阶段发生的是界面破坏和内聚破坏,这就是两组样品
GIC 不同但GIR 相近的原因。再对GB36#/EP样品的破坏面进行观察(见图11(d)),不难看出其层间断裂的模式也是内聚破坏,但与GB36#试件的破坏面形貌稍有不同,出现差异的原因有:树脂层厚度的增加会扩大裂纹扩展的范围(见图12(b)和12(c)),延长裂纹扩展路径[25],这也是GB36#/EP试件层间断裂韧性比GB36#试件高的原因。将GB36#/EP与GB36#/AF两组试件进行对比,GB36#/AF层间断裂韧性比GB36#/EP试样高,可能原因有:胶膜中本身包含的短切纤维的桥接作用有利于裂纹的偏转和胶层的增强增韧;胶膜插层的厚度大于纯树脂插层的厚度,意味着容许裂纹扩展的范围增大(见图12(f));胶膜基体与环氧树脂基体本身的力学性能差异等。3. 结 论
(1)通过双悬臂梁(DCB)试验结果,可以得知采用金属表面处理和界面插层协同增韧的方案,能最大限度地提高纤维-金属层合板的层间断裂韧性。其中喷砂/界面胶膜插层(GB36#/AF)试件的I型断裂韧性
GIC 和断裂阻抗GIR 相比于脱脂试件提高了343%和254%;GB36#/EP试件的GIC 和GIR 相比于脱脂试件提高了129%和100%。(2)根据内聚单元建立的有限元模型及临界载荷
PC 和I型断裂韧性GIC 等相关参数,得到了I型加载模拟结果,且与实验曲线对比拟合程度较好。(3)通过断裂面形貌观测,可以发现各组试件的失效破坏特征有所差异。对于脱脂和金属打磨的试件,其失效模式主要是界面失效;对于喷砂和插层试件,破坏模式主要为内聚失效。
(4)基于以上表征和观测,揭示了碳纤维增强树脂复合材料(CFRP)-热成型钢界面的增强增韧机制。提高钢板表面的粗糙度,可以有效地提高钢板与聚合物基体的机械联锁作用;在金属-CFRP复合材料界面之间插层胶膜或树脂,可以有效地扩大裂纹扩展的范围,延长裂纹扩展路径;另外胶膜内部含有很多短切纤维,短切纤维的桥接作用使裂纹在扩展时发生偏转,从而导致基体的塑性破坏,吸收更多的能量。
-
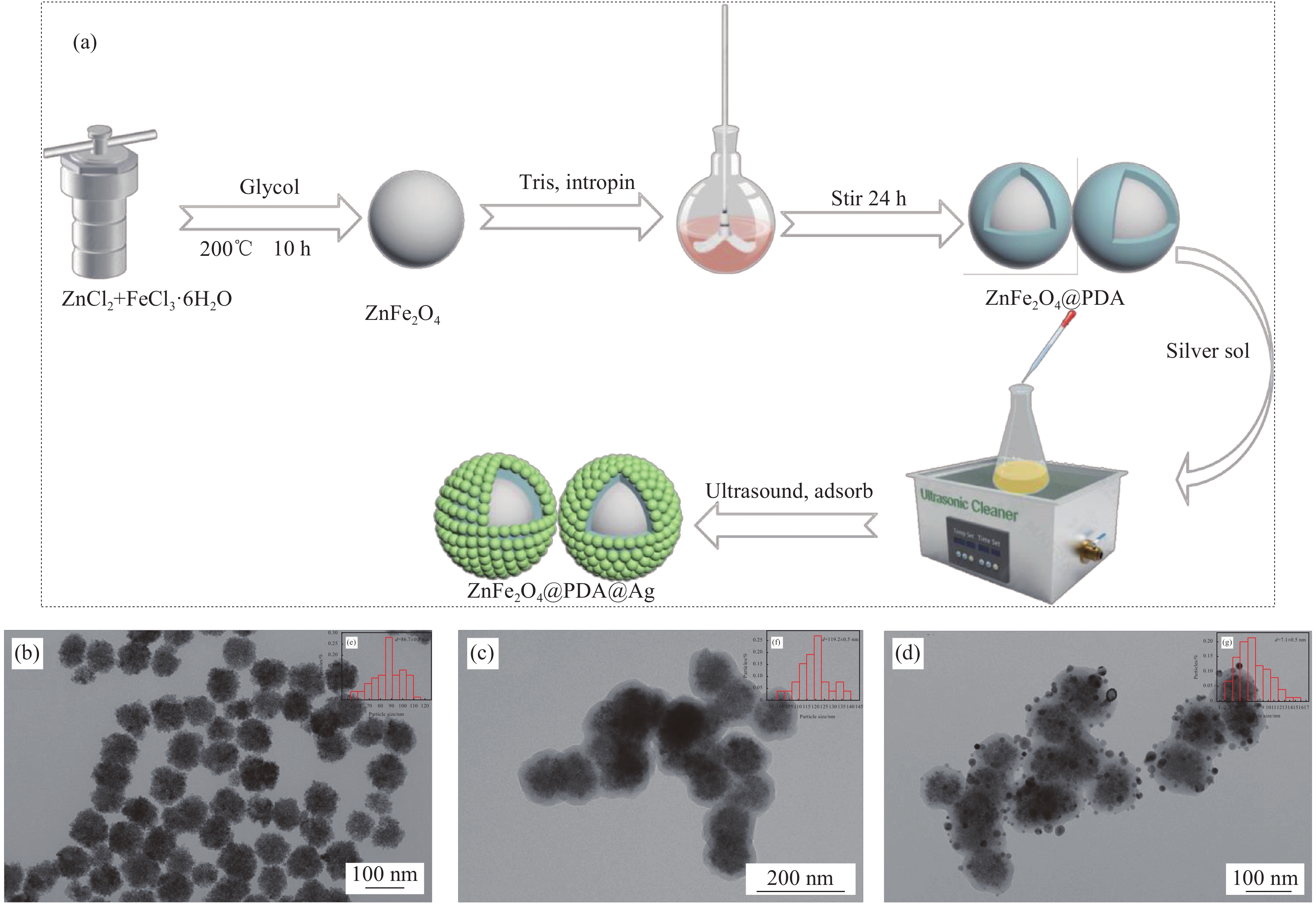
图 1 (a) 磁性铁酸锌(ZnFe2O4)@聚多巴胺(PDA)@Ag纳米复合材料的制备流程图;ZnFe2O4 (b)、ZnFe2O4@PDA (c)、ZnFe2O4@PDA@Ag (d) 的TEM图像;ZnFe2O4 (e)、ZnFe2O4@PDA (f)、Ag纳米颗粒(NPs) (g)的粒径分布图
Figure 1. (a) Magnetic zinc ferrite (ZnFe2O4)@polydopamine (PDA)@Ag nanocomposite preparation flowchart; TEM images of ZnFe2O4 (b), ZnFe2O4@PDA (c), ZnFe2O4@PDA@Ag (d); Particle size distribution of ZnFe2O4 (e), ZnFe2O4@PDA (f), Ag nanoparticles (NPs) (g)
d—Particle size
图 2 ZnFe2O4、ZnFe2O4@PDA、ZnFe2O4@PDA@Ag纳米复合材料表征:((a)~(f)) ZnFe2O4@PDA@Ag的XPS图谱;(g) ZnFe2O4、ZnFe2O4@PDA、ZnFe2O4@PDA@Ag、Ag NPs的XRD图谱;(h) ZnFe2O4、ZnFe2O4@PDA、ZnFe2O4@PDA@Ag、Ag NPs的紫外吸收光谱图;(i) Ag NPs、ZnFe2O4、ZnFe2O4@PDA、ZnFe2O4@PDA@Ag的FTIR图谱
Figure 2. Characterization of ZnFe2O4, ZnFe2O4@PDA, ZnFe2O4@PDA@Ag nanocomposite: ((a)-(f)) XPS spectra of ZnFe2O4@PDA@Ag; (g) XRD patterns of ZnFe2O4, ZnFe2O4@PDA, ZnFe2O4@PDA@Ag and Ag NPs; (h) UV-Vis absorption spectra of ZnFe2O4, ZnFe2O4@PDA, ZnFe2O4@PDA@Ag and Ag NPs; (i) FTIR spectra of ZnFe2O4, ZnFe2O4@PDA, ZnFe2O4@PDA@Ag and Ag NPs
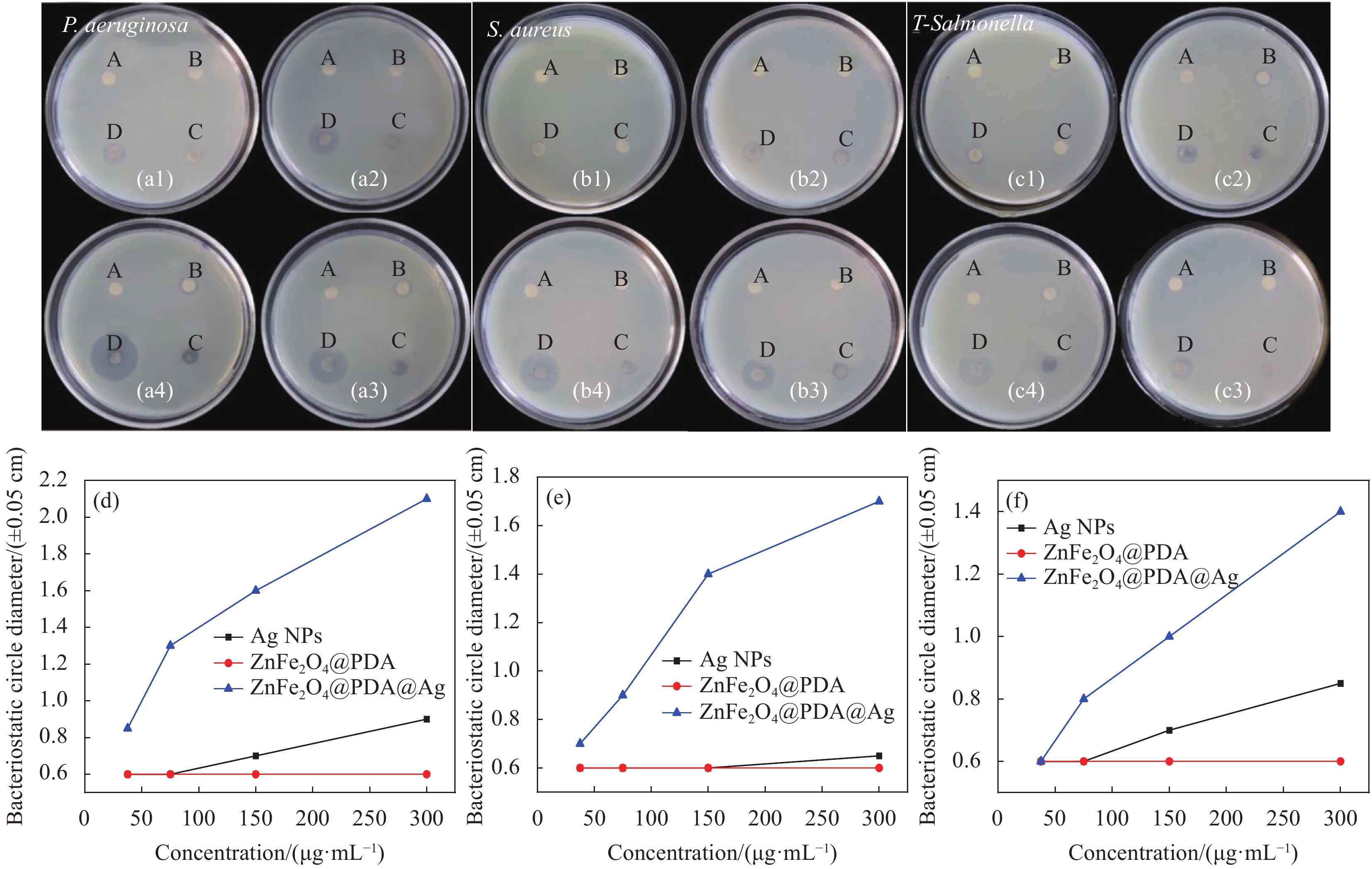
图 3 不同材料对铜绿假单胞菌(P. aeruginosa)、金黄色葡萄球菌(S. aureus)和耐药菌沙门氏菌(T-Salmonella)的滤纸片扩散照片:((a1)~(a4)) 浓度为50、100、200、400 μg/mL的不同抑菌材料(Ag NPs负载量0.39%)对P. aeruginosa的抑菌结果照片;((b1)~(b4), (c1)~(c4)) S. aureus及T-Salmonella的抑菌结果照片;((d)~(f)) 不同材料对P. aeruginosa、S. aureus、T-Salmonella的抑菌圈直径随浓度变化曲线
Figure 3. Different materials for pseudomonas aeruginosa (P. aeruginosa), staphylococcus aureus (S. aureus) and drug-resistant salmonella (T-Salmonella) filter paper spread photos: (a1)-(a4)) Bacteriostatic results photos of P. aeruginosa of different bacteriostatic materials (Loading of Ag NPs was 0.39%) with concentrations of 50, 100, 200 and 400 μg/mL; ((b1)-(b4), (c1)-(c4)) Antibacterial results photos against S. aureus and T-Salmonella; ((d)-(f)) Change curves of bacillus inhibition circle diameter with concentration on P. aeruginosa, S. aureus and T-Salmonella of different materials
A, B, C and D correspond to distilled water, Ag NPs, ZnFe2O4@PDA and ZnFe2O4@PDA@Ag, respectively.
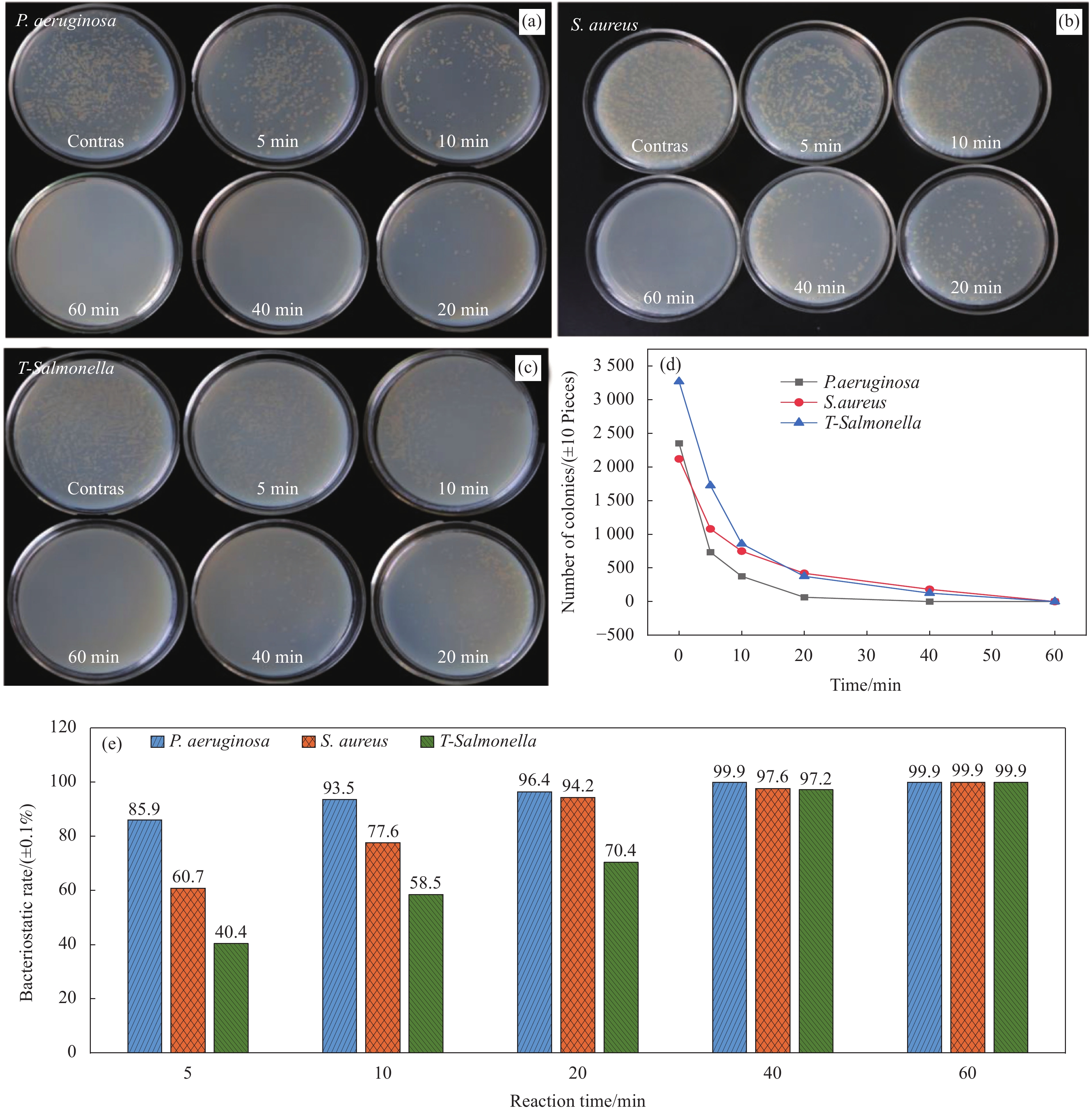
图 4 ZnFe2O4@PDA@Ag纳米复合材料菌落计数照片:纳米复合材料抑制P. aeruginosa (a)、 S. aureus (b) 及 T-Salmonella (c) 的菌落计数分布图;(d) 纳米复合材料的时间-杀菌曲线;(e) 纳米复合材料对3种测试菌在不同时间的抑菌率比较图
Figure 4. Photos of colony count of ZnFe2O4@PDA@Ag nanocomposite: Distribution of colony count of nanocomposite materials inhibiting P. aeruginosa (a), S. aureus (b) and T-Salmonella (c); (d) Time-germicidal curves of the nanocomposite; (e) Comparison of the antibacterial rate of the nano-composite against the 3 tested bacteria at different time
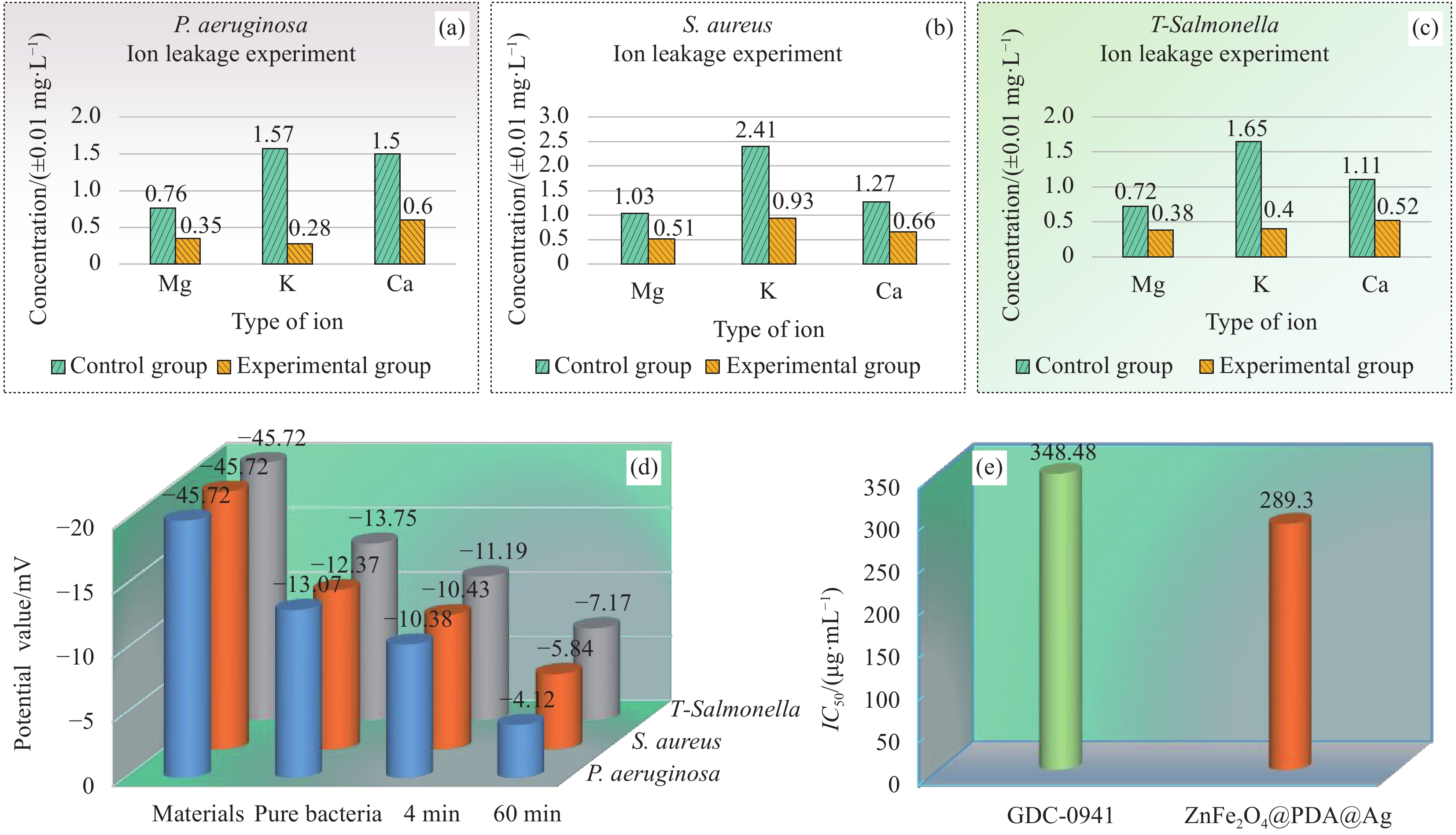
图 5 ZnFe2O4@PDA@Ag纳米复合材料抑菌机制实验结果图:((a)~(c)) 纳米复合材料作用P. aeruginosa (a)、S. aureus (b) 及T-Salmonella (c)的离子泄露实验结果;(d) 纳米复合材料与3种测试菌作用不同时间的Zeta电位值图;(e) 纳米复合材料的毒理性实验结果分析
Figure 5. Experimental result of bacteriostatic mechanism of ZnFe2O4@PDA@Ag nanocomposite material: ((a)-(c)) Results of ion leakage of nanocomposite materials acting on P. aeruginosa (a), S. aureus (b) and T-Salmonella (c); (d) Zeta potential values of nanocomposite materials interacting with the three tested bacteria at different time; (e) Analysis of experimental results of toxicity of nanocomposite materials
IC50—Half maximal inhibitory concentration
图 6 P. aeruginosa (a)、S.aureus (b) 、T-Salmonella (c) 纯菌及ZnFe2O4@PDA@Ag纳米复合材料对P. aeruginosa (d)、S.aureus (e) 及T-Salmonella (f) 的碘化丙啶(PI)染色照片
Figure 6. Propyl iodide (PI) staining photos of P. aeruginosa (a), S.aureus (b), T-Salmonella (c) and ZnFe2O4@PDA@Ag nanocomposite of P. aeruginosa (d), S. aureus (e) and T-Salmonella (f)
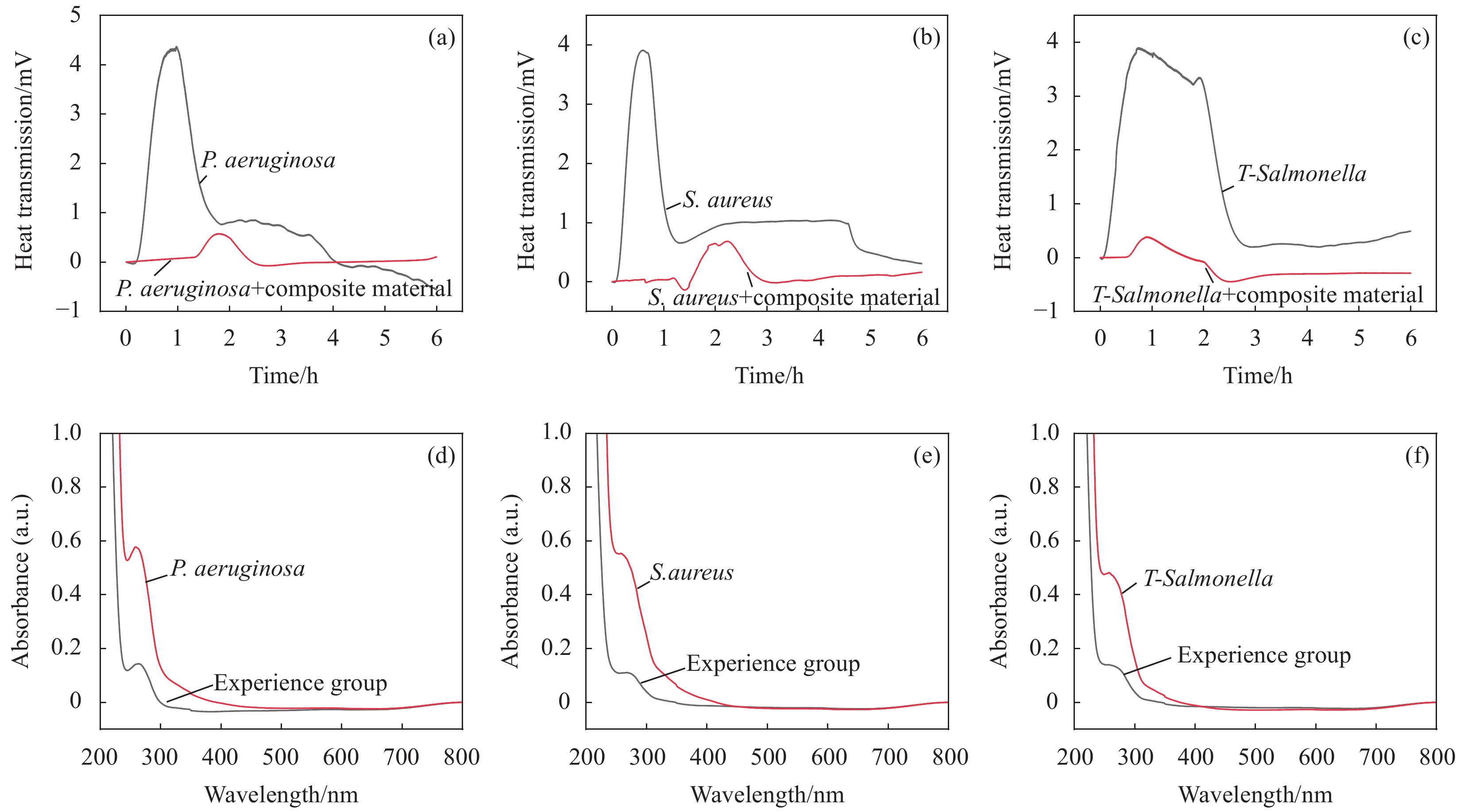
图 7 ZnFe2O4@PDA@Ag纳米复合材料作用3种测试菌的微量热及细胞质泄露实验结果分析:纳米复合材料作用P. aeruginosa (a)、S. aureus (b) 和T-Salmonella (c) 的微量热实验结果图;纳米复合材料作用P. aeruginosa (d)、S. aureus (e) 和T-Salmonella (f) 的细胞质泄露实验结果
Figure 7. Microthermal analysis of ZnFe2O4@PDA@Ag nanocomposite for three kinds of test bacteria and analysis of cytoplasmic leakage experiment results: Microcaloric experimental results of nanocomposite materials acting on P. aeruginosa (a), S. aureus (b) and T-Salmonella (c); Cytoplasmic leakage test results of nanocomposite materials under the action of P. aeruginosa (d), S. aureus (e) and T-Salmonella (f)
表 1 溶剂、Ag NPs、ZnFe2O4@PDA、ZnFe2O4@PDA@Ag对P. aeruginosa、S. aureus和T-Salmonella的抑菌圈尺寸
Table 1 Size of bacteriostasis circles for P. aeruginosa, S. aureus and T-Salmonella of solvent, Ag NPs, ZnFe2O4@PDA and ZnFe2O4@PDA@Ag
Bacterial Concentration/(μg·mL−1) Inhibition zones/(±0.05 cm) H2O Ag ZnFe2O4@PDA ZnFe2O4@PDA@Ag P. aeruginosa 50 0.6 0.6 0.6 0.85 100 0.6 0.6 0.6 1.3 200 0.6 0.7 0.6 1.6 400 0.6 0.9 0.6 2.1 S. aureus 50 0.6 0.6 0.6 0.7 100 0.6 0.6 0.6 0.9 200 0.6 0.6 0.6 1.4 400 0.6 0.65 0.6 1.7 T-Salmonella 50 0.6 0.6 0.6 0.6 100 0.6 0.6 0.6 0.8 200 0.6 0.7 0.6 1.0 400 0.6 0.85 0.6 1.4 -
[1] ZENG H P, LI J X, ZHAO W H, et al. The current status and prevention of antibiotic pollution in groundwater in China[J]. International Journal of Environmental Research and Public Health,2022,19(18):11256. DOI: 10.3390/ijerph191811256
[2] HESS J. Rational approaches towards inorganic and organometallic antibacterials[J]. Biological Chemistry,2021,403(4):363-375. DOI: 10.1515/hsz-2021-0253
[3] MO F, ZHOU Q X, HE Y Q. Nano-Ag: Environmental applications and perspectives[J]. Science of the Total Environment,2022,829:154644. DOI: 10.1016/j.scitotenv.2022.154644
[4] ZHANG J, WANG F, YALAMARTY S S K, et al. Nano silver-induced toxicity and associated mechanisms[J]. International Journal of Nanomedicine,2022,2022(17):1851-1864.
[5] WANG L J, LYU H, LI B J, et al. Synthesis and antibacterial activity of Ag/CeO2 hybrid architectures[J]. Journal of Sol-Gel Science and Technology,2018,88(3):654-659. DOI: 10.1007/s10971-018-4855-z
[6] 郭少波, 梁艳莉, 季晓晖, 等. 纳米核壳型Ag@Fe3O4复合材料的制备、催化及抑菌性能[J]. 复合材料学报, 2021, 38(3):816-823. GUO Shaobo, LIANG Yanli, JI Xiaohui, et al. Preparation, catalytic property and antibacterial property of Ag@Fe3O4 core-shell composite nanomaterials[J]. Acta Materiae Compositae Sinica,2021,38(3):816-823(in Chinese).
[7] FANG Q L, XU K Z, ZHANG J F, et al. Hybrid polydopamine/Ag shell-encapsulated magnetic Fe3O4 nanosphere with high antibacterial activity[J]. Materials,2020,13(17):3872. DOI: 10.3390/ma13173872
[8] LI X Z, LI B Y, LIU Y H, et al. Development of pH-responsive nanocomposites with remarkably synergistic antibiofilm activities based on ultrasmall silver nanoparticles in combination with aminoglycoside antibiotics[J]. Colloids and Surfaces B: Biointerfaces,2021,208:112112. DOI: 10.1016/j.colsurfb.2021.112112
[9] 解修超, 兰阿峰, 刘二奴, 等. PDA@Ag纳米复合材料的制备及抑菌性能研究[J]. 贵金属, 2021, 42(1):34-40. DOI: 10.3969/j.issn.1004-0676.2021.01.007 XIE Xiuchao, LAN Afeng, LIU Ernu, et al. Study on preparation and antibacterial property of PDA@Ag composite nanomaterials[J]. Precious Metals,2021,42(1):34-40(in Chinese). DOI: 10.3969/j.issn.1004-0676.2021.01.007
[10] KHINA A G, KRUTYAKOV Y A. Similarities and differences in the mechanism of antibacterial action of silver ions and nanoparticles[J]. Applied Biochemistry and Microbiology,2021,57(6):683-693. DOI: 10.1134/S0003683821060053
[11] HAGHNIAZ R, RABBANI A, VAJHADIN F, et al. Anti-bacterial and wound healing promoting efects of zinc ferrite nanoparticles[J]. Journal of Nanobiotechnology, 2021, 19(38: 00776.
[12] WANG H Q, LIU M H, LUO X, et al. Preparation of ZnFe2O4/AC composite and its adsorption behaviour for SO2[J]. Environmental Technology,2020,41(18):2412-2423. DOI: 10.1080/09593330.2019.1567608
[13] PU J, ZHANG Z H, ZHANG H J, et al. Efficacy of bactericides against potato common scab caused by Streptomyces in Yunnan, China[J]. American Journal of Potato Research,2022,99(4):326-335. DOI: 10.1007/s12230-022-09883-2
[14] ZHANG N, PENG S S, LIU Z Y, et al. Ag NPs decorated on the magnetic Fe3O4@PDA as efficient catalyst for organic pollutants removal and as effective antimicrobial agent for microbial inhibition[J]. Journal of Alloys and Compounds,2022,928(20):167257.
[15] THEINER S, LOEHR K, KOELLENSPERGER G, et al. Single-cell analysis by use of ICP-MS[J]. Journal of Analytical Atomic Spectrometry,2020,35(9):1784-1813. DOI: 10.1039/D0JA00194E
[16] RASMUSSEN L, SHI H L, LIU W Y, et al. Quantification of silver nanoparticle interactions with yeast Saccharomyces cerevisiae studied using single-cell ICP-MS[J]. Analytical and Bioanalytical Chemistry,2022,414(9):3077-3086. DOI: 10.1007/s00216-022-03937-4
[17] ANITHA R, RAMESH K V, SUDHEER K K H, et al. Cytotoxicity, antibacterial and antifungal activities of ZnO nanoparticles prepared by the Artocarpus gomezianus fruit mediated facile green combustion method[J]. Journal of Science: Advanced Materials and Devices,2018,3(4):440-451. DOI: 10.1016/j.jsamd.2018.11.001
[18] WANG X J, MEI L, JIN M C, et al. Composite coating of graphene oxide/TiO2 nanotubes/HHC-36 antibacterial peptide construction and an exploration of its bacteriostat and osteogenesis effects[J]. Journal of Biomedical Nanotechnology,2021,17(4):662-676. DOI: 10.1166/jbn.2021.3013
[19] HNIN Y L, YUKARI A N, AOI M, et al. Soybean peptide inhibits the biofilm of periodontopathic bacteria via bactericidal activity[J]. Archives of Oral Biology,2022,142:105497. DOI: 10.1016/j.archoralbio.2022.105497
[20] CIRNSHI K, COETZEE J, HERRMANN J, et al. Metabolic profiling to determine bactericidal or bacteriostatic effects of new natural products using isothermal microcalorimetry[J]. Journal of Visualized Experiments,2020,164:e61703.
[21] YANG H Y, CHANG C M, CHEN Y W, et al. Inhibitory effect of propolis extract on the growth of Listeria monocytogenes and the mutagenicity of 4-nitroquinoline-N-oxide[J]. Journal of the Science of Food and Agriculture,2006,86(6):937-943. DOI: 10.1002/jsfa.2441
[22] LUO M B, ZHANG Y J, ZHAO S. Non-enzymatic hydrogen peroxide sensor based on Fe3O4@polydopamine-Ag nanocomposite modified magnetic glassy carbon electrode[J]. Journal of the Electrochemical Society,2021,168(6):067511. DOI: 10.1149/1945-7111/ac0604
[23] TOMAR D, JEEVANANDAM P. Synthesis of ZnFe2O4 nanoparticles with different morphologies via thermal decomposition approach and studies on their magnetic properties[J]. Journal of Magnetism and Magnetic Materials,2022,564(1):170033.
[24] CAI C, ZHANG Z Y, LIU J, et al. Visible light-assisted heterogeneous Fenton with ZnFe2O4 for the degradation of orange II in water[J]. Applied Catalysis B: Environmental,2016,182:456-468. DOI: 10.1016/j.apcatb.2015.09.056
[25] CUI K X, YAN B, XIE Y J, et al. Regenerable urchin-like Fe3O4@PDA-Ag hollow microspheres as catalyst and adsorbent for enhanced removal of organic dyes[J]. Journal of Hazardous Materials,2018,350:66-75. DOI: 10.1016/j.jhazmat.2018.02.011
[26] ZHAO Z Y, LI P J, CAO X Y, et al. Novel strategies for the preparation of nano-silver pectin sponge composite and its antibacterial properties[J]. Cellulose,2023,30:9425 − 9437. DOI: 10.1007/s10570-023-05458-4
[27] FANG Y, HONG C Q, CHEN F R, et al. Green synthesis of nano silver by tea extract with high antimicrobial activity[J]. Inorganic Chemistry Communications,2021,132:108808. DOI: 10.1016/j.inoche.2021.108808
[28] MELIKE S Y, MUSTAFA C, TANSEI S, et al. Silica coated ZnFe2O4 nanoparticles as cathode catalysts for rechargeable lithium-air batteries[J]. Batteries & Supercaps,2019,2(4):380-386. DOI: 10.1002/batt.201800095
[29] ZOU Y K, YAN R, WANG H B, et al. NIR-responsive polyurethane nanocomposites based on PDA@FA nanoparticles with synergistic antibacterial effect[J]. Macromolecular Chemistry and Physics,2022,223(19):2200141. DOI: 10.1002/macp.202200141
[30] MA Z F, JIANG X Y, JIN Y H, et al. Preparation of nano-silver nanoparticles for conductive ink and the correlations with its conductivity[J]. Applied Nanoscience, 2022, 12(5): 1657-1665.
[31] KANAGESAN S, HASHIM M, AZIZS A, et al. Evaluation of antioxidant and cytotoxicity activities of copper ferrite (CuFe2O4) and zinc ferrite (ZnFe2O4) nanoparticles synthesized by sol-gel self-combustion method[J]. Applied Sciences,2016,6(9):184. DOI: 10.3390/app6090184
[32] YARI A, DERKI S, et al. New MWCNT-Fe3O4@PDA-Ag nanocomposite as a novel sensing element of an electrochemical sensor for determination of guanine and adenine contents of DNA[J]. Sensors and Actuators B: Chemical ,2016,227:456466. DOI: 10.1016/j.snb.2015.12.088
[33] FERREYRA MAILLARD A P V, ESPECHE J C, MATURANA P, et al. Zeta potential beyond materials science: Applications to bacterial systems and to the development of novel antimicrobials[J]. Biochimica et Biophysica Acta (BBA)- Biomembranes,2021,1863(6):183597. DOI: 10.1016/j.bbamem.2021.183597
[34] WANG X L, LI Y, HUANG J, et al. Efficiency and mechanism of adsorption of low concentration uranium in water by extracellular polymeric substances[J]. Journal of Environmental Radioactivity,2019,197:81-89. DOI: 10.1016/j.jenvrad.2018.12.002
[35] YADAV A K, SIROHI P, SARASWAT S, et al. Inhibitory mechanism on combination of phytic acid with methanolic seed extract of Syzygium cumini and sodium chloride over Bacillus subtilis[J]. Current Microbiology,2018,75(7):849-856. DOI: 10.1007/s00284-018-1457-5
[36] WANG Y, ZHU H L, FENG J G, et al. Recent advances of microcalorimetry for studying cellular metabolic heat[J]. Trends in Analytical Chemistry,2021,143:116353-116362. DOI: 10.1016/j.trac.2021.116353
[37] DONG Y H, ZHU H L, SHEN Y Y, et al. Antibacterial activity of silver nanoparticles of different particle size against Vibrio Natriegens[J]. Plos One, 2019, 14(9): e0222322.
[38] HOVHANNISYAN Z, TIMOTINA M, MANOYAN J, et al. Ribes nigrum L. extract-mediated green synthesis and antibacterial action mechanisms of silver nanoparticles[J]. Antibiotics,2022,11(10):1415. DOI: 10.3390/antibiotics11101415
[39] FRANCO D, CALABRESE G, CONOCI S, et al. Metal-based nanoparticles: Antibacterial mechanisms and biomedical application[J]. Microorganisms,2022,10(9):1778. DOI: 10.3390/microorganisms10091778
[40] YANG R, LIANG B, HAN D, et al. Synthesis and antibacterial activity of magnetic Fe3O4-loaded silver nanocompo-sites[J]. Journal of Alloys and Compounds,2023,973:172849. DOI: 10.1016/j.jallcom.2023.172849
-
期刊类型引用(1)
1. 李登高,刘成霞. 有限元分析技术在织物力学性能领域的应用. 现代纺织技术. 2024(06): 129-141 .  百度学术
百度学术
其他类型引用(0)
-
目的
抗生素的滥用导致大量耐药菌出现对社会健康造成了严重的威胁。因此,迫切需要开发新型、有效持久的抗菌剂,以应对日益增长的公共卫生需求。
方法以FeCl、NaAc和ZnCl为原料用“热溶剂法”制备磁性铁酸锌(ZnFeO),再以ZnFeO为核进行聚多巴胺(PDA)包覆形成ZnFeO@PDA纳米微球,最后将由化学还原法制备的粒径在2-16 nm的银纳米颗粒(Ag NPs)负载于ZnFeO@PDA表面,形成ZnFeO@PDA@Ag纳米复合材料。通过透射电子显微镜(TEM)、X射线衍射仪(XRD)、X射线光电子能谱(XPS)、紫外-可见吸收光谱(UV-Vis)、傅里叶红外光谱(FT-IR)、Zeta电位等表征材料形貌特征。以革兰氏阴性菌铜绿假单胞菌()、革兰氏阳性菌金黄色葡萄球菌()和耐药菌沙门氏菌()为模式菌,研究ZnFeO@PDA@Ag材料的抑菌活性及抑菌机制。
结果通过TEM、XPS可得,所制备的ZnFeO@PDA@Ag为纳米核壳结构,ZnFeO NPs核为均匀的球形结构,其平均粒径约86.7 nm,多巴胺均匀覆盖在ZnFeO表面,平均粒径约为119.2 nm,其次,纳米银小颗粒附着与PDA表层,小颗粒Ag NPs其平均粒径为7.1 nm。由此可表明ZnFeO@PDA@Ag纳米复合材料的成功制备。XRD谱图显示ZnFeO与ZnFeO@PDA的谱图,两者谱图无明显差异,这是由于PDA是一种非晶聚合物,受远程无序性所限,其在XRD测试中无法得到特征峰,且其衍射峰刚好与标准卡片对应。最后观察ZnFeO@PDA@Ag的谱图,可以看出该纳米粒子的特征峰刚好包含了Ag NPs与ZnFeO的所有特征峰且无杂峰,由此可进一步证明ZnFeO@PDA@Ag纳米复合材料的成功制备。并通过UV-Vis、FT-IR对复合材料的成功制备进行了进一步验证。抑菌性能结果显示,相比于同比例浓度的Ag NPs(负载量0.39%),材料对的抑菌率提升了57.1%、对和提升值分别为61.7%和39.2%。材料浓度为200 μg/mL,作用时间60 min条件下,ZnFeO@PDA@Ag对测试菌抑制率均可达到99.9%。抑菌机制结果证实,ZnFeO@PDA@Ag可与细胞壁表面蛋白作用破坏细胞壁,进入细菌内部与胞内蛋白和相关酶作用阻碍细胞呼吸,且破坏DNA结构并抑制其复制过程,从而影响细菌呼吸和细胞分裂等生理生化过程,最终导致细菌死亡。
结论本文成功制备了ZnFeO@PDA@Ag纳米复合材料,ZnFeO@PDA@Ag纳米复合材料很好地解决了小颗粒纳米银易团聚的问题,进而较大程度地提升了纳米银的抑菌性能。此外,ZnFeO的磁性使纳米复合材料能够被重复利用,有效地降低了材料成本。最终该材料有望于在医疗器械以及污水处理等领域有很大的应用前景。
-
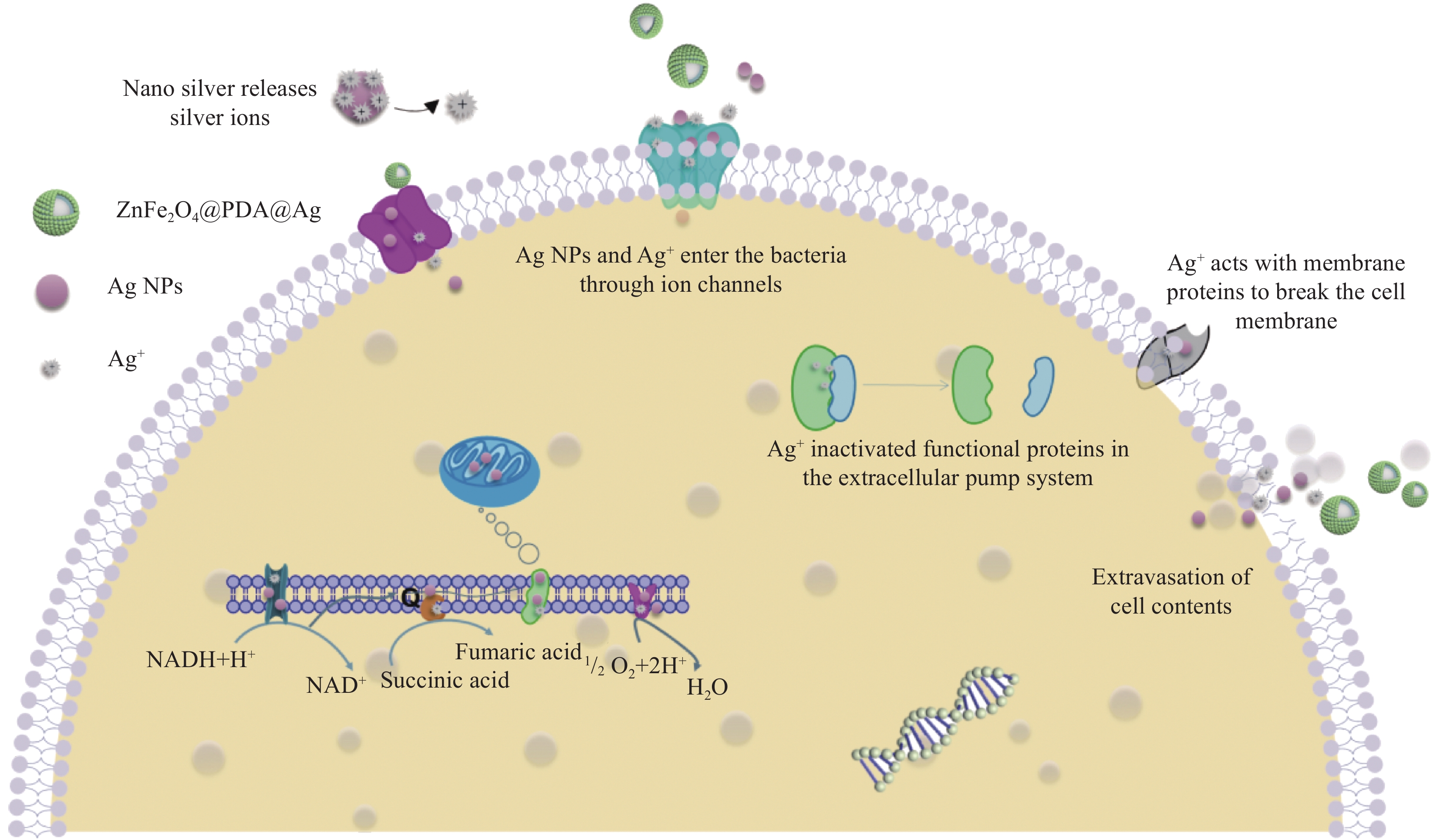
本文以磁性ZnFe2O4为核,PDA包覆后,再将化学还原法所制备2-16 nm银纳米颗粒进行负载,最终得到ZnFe2O4@PDA@Ag纳米复合材料。以革兰氏阴性菌P. aeruginosa、革兰氏阳性菌S. aureus和耐药菌T-Salmonella为模型菌,研究纳米复合材料的协同抑菌活性,并讨论抑菌机制。该材料不仅解决了Ag NPs易团聚所导致效能差问题,同时因小颗粒Ag NPs可直接通过离子通道进入细菌内部,而具备了高效抗菌活性;其次,以磁性ZnFe2O4为内核,可实现材料重复利用,降低了使用成本;最后PDA层的包覆可使纳米复合材料有良好的生物相容性。上述工作可为新型、智能化抗生素材料的研发提供理论依据。
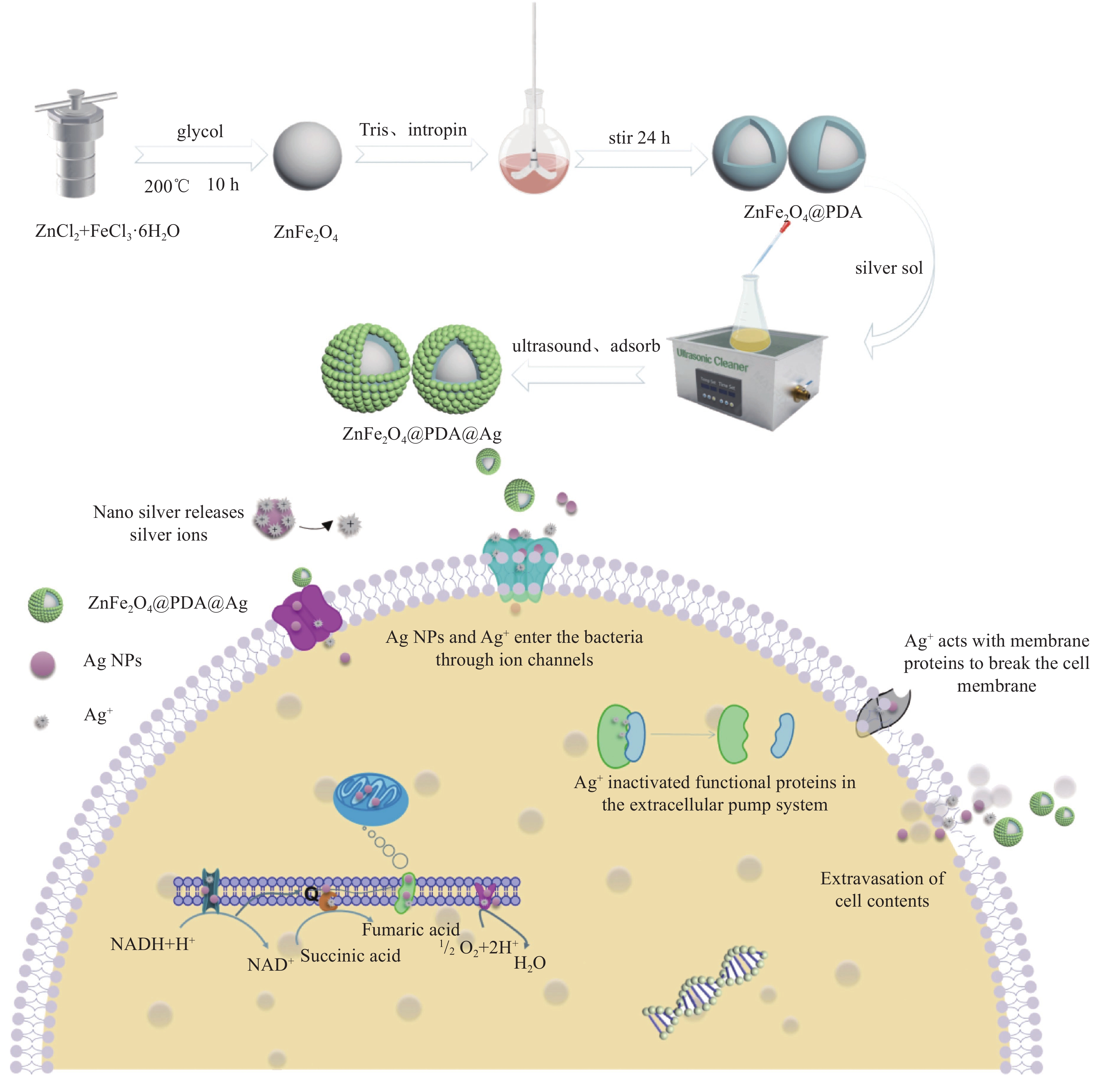
ZnFe2O4@PDA@Ag纳米复合材料制备流程和抑菌机制图




 下载:
下载: