Biomechanical properties of a customizable thermoplastic polyurethane/ polycaprolactone blended esophageal stent fabricated by 3D printing
-
摘要:
食管支架在食管疾病的临床治疗中有广泛的应用。但商业食管支架尺寸固定,无法根据患者食管的几何形状进行个性化定制。通过熔融共混结合3D打印技术的方式制备了一种热塑性聚氨酯(TPU)/聚己内酯(PCL)共混物食管支架,并基于对TPU/PCL组分比例的调节,实现了对支架力学性能的调控。通过差示扫描量热、热重分析、力学试验、体外降解试验和细胞毒性检测研究了TPU/PCL共混物的理化特性及支架的各项关键指标。结果表明,TPU/PCL共混物具有良好的材料相容性和力学性能,且细胞活性为72.9%,对细胞无潜在毒性。经过为期8周的体外降解试验,支架的质量损失均小于2%,且力学性能无明显变化。3D打印TPU/PCL共混物支架优越的力学和生物学性能证明了其在食管狭窄的临床个性化治疗中具有潜在应用前景。
Abstract:Esophageal stents are widely used in the clinical therapy of esophageal diseases. However, commercial esophageal stents have fixed sizes and cannot be personalized according to esophageal geometry of patient. A thermoplastic polyurethane (TPU)/polycaprolactone (PCL) blend esophageal stent was prepared by melt blending combined with 3D printing technology. Based on the adjustment of TPU/PCL component ratio, the mechanical properties of the stent were regulated. The physicochemical properties of TPU/PCL blends and the key parameters of the stents were investigated by differential scanning calorimetry, thermogravimetric analysis, mechanical tests, in vitro degradation tests and cytotoxicity assays. The results show that the TPU/PCL blends exhibit favorable compatibility and mechanical properties, and the cellular activity is 72.9% with no potential toxicity to cells. The mass of the stents is less than 2%, and the mechanical properties do not change significantly after 8 weeks in vitro degradation test. The superior mechanical and biological features of 3D printed TPU/PCL blended stent demonstrate the potential application in the clinical personalized treatment of esophageal stenosis.
-
Keywords:
- 3D printing /
- esophageal stent /
- mechanical property /
- TPU/PCL /
- biocompatibility
-
在临床上,使用食管支架治疗各种食管疾病是一种有效的方法。食管支架不仅可以缓解良性食管狭窄和吞咽困难的症状,而且对于晚期食管癌患者,还可以打开阻塞的食管以供进食[1-2]。目前,镍钛合金自膨胀式金属支架因其具有较好的力学性能和可压缩性被广泛用于缓解恶性吞咽困难[3-5]。但自膨胀式金属支架在手术的早期或晚期会引起包括肿瘤组织长入、出血、狭窄复发、穿孔、反流疾病、支架滑落入胃等并发症,造成患者不适,影响治疗效果[6-7]。这明确需要在制造工艺、结构和材料等方面开发更先进的支架。
随着3D打印技术的快速发展,医疗器械领域对个性化定制人工器官和医疗器械的需求日益增长[8-10]。例如,贾李涵等[11]研发了力学性能优异的3D打印纳米纤维素增强聚乳酸血管支架。Yang等[12]设计了具有细胞相容性和生物相容性的3D打印骨传导复合支架。这些研究表明,3D打印技术在制造生物材料方面具有显著优势。因此,本文拟采用熔融沉积(Fused deposition modeling,FDM)方法进行3D打印,这是一种更易于使用且具有成本效益的共混物复合材料制造打印技术[13]。
用于制作食管支架的材料需要具有优异的生物相容性和材料相容性。本文所制备的支架由热塑性聚氨酯(Thermoplastic polyurethane,TPU)和聚己内酯(Polycaprolactone,PCL)组成。TPU是一种具有生物相容性的聚合物,为设计医疗器械提供了可行性。同时具有较高的抗拉强度、耐磨性、抗撕裂性和低温柔韧性,在医学和组织工程领域具有潜在的应用价值[14]。PCL是一种生物可降解聚酯,目前已被美国食品药品监督管理局批准作为医用植入和药物输送装置[15]。PCL具有可利用性、可降解性、抗拉强度高和生物相容性好等优点,因此在组织工程领域得到了广泛的应用[16]。然而,PCL的高结晶性和疏水性导致其降解速率较慢,在体内完全降解往往需要两年以上[17-18]。已有研究表明,TPU/PCL共混物的熔融行为与纯PCL相似,具有良好的混溶性、相容性和形状记忆性能,在TPU中加入PCL制备成共混物不仅不会显著劣化原有的断后伸长率,还能进一步提高拉伸强度和硬度[19-21]。目前,许多学者将TPU/PCL用于各种医疗器械的制造,如王慧[22]使用FDM的3D打印方法制备了TPU/PCL骨软骨双层支架。因此,将柔性TPU弹性体与刚性PCL熔融共混有望开发出具有良好生物相容性和力学性能可控的柔性食管支架[23]。
鉴于上述研究,本研究拟采用3D打印技术,开发一种能够通过对支架共混物材料组分的调节而调控其力学性能的新型食管支架。将TPU和PCL以不同比例组合,制成具有不同力学性能的食管支架,使患者能有更多的治疗选择,进而在不对食管壁施加过大应力的情况下,具备更好的抗迁移性能并保持食管持续通畅。同时,可以根据患者的治疗需求和食管的几何形状定制支架,实现个性化食管支架的快速制造。
1. 实验材料及方法
1.1 原材料
热塑性聚氨酯(Thermoplastic polyurethane,TPU):密度1.14~1.18 g/cm3,邵氏硬度60A,中国东莞德创有限公司。聚己内酯(Polycaprolactone,PCL):600C (数均分子量Mn=
65000 ):中国深圳eSUN工业有限公司。所有材料均为市售原料,未经过进一步纯化处理。1.2 共混物的制备
如图1所示,使用同向双螺杆挤出机(螺杆直径2 cm,长径比为40/1,中国南京哈斯挤压设备有限公司)制备了多种质量组分比例的热塑性聚氨酯(TPU)/聚己内酯(PCL)共混物材料(纯PCL、80TPU/20PCL、70TPU/30PCL、60TPU/40PCL和纯TPU)。将TPU和PCL分别在80℃和50℃干燥24 h,然后手动配制组分比例。将挤出机机筒的控温区温度设置为180~190℃,螺杆转速为25 r/min,将挤出的熔融共混物在冷却水浴中冷却成型,然后造粒。
1.3 力学性能
力学测试标准样品的制备:将颗粒在50℃的真空烘箱中干燥24 h以去除水分,然后使用KINGSU 35T-2型注塑成型机(中国东莞市金速设备有限公司)进行注塑。喷嘴温度为185℃,喷射压力40 MPa。
拉伸性能测试:根据ISO 527-2: 2012标准[24],采用JJ UTM-1422型万能试验机(中国承德市金建测试仪器有限公司)在25℃下进行拉伸试验,加载速率为20 mm/min。因仪器量程限制,设定最大拉应变为520%作为试验终止的标准。
弯曲性能测试:根据ISO 178: 2019标准[25],用万能试验机测试所有样品的弯曲强度,位移速率为2 mm/min。结果取5个样本的平均值。
1.4 支架的设计与制作
采用计算机辅助设计软件SolidWorks进行支架的设计,并将得到的STL格式文件在Creality Print (Version3.5.9.0)切片软件中进行切片处理。然后,使用G5型3D打印机(深圳创想三维科技有限公司)打印支架。不同组分比共混物的打印参数见表1。
表 1 不同组分比TPU/PCL共混物的打印参数Table 1. Printing parameters of TPU/PCL blends with different component ratiosSample Nozzle
temperature/℃Build plate
temperature/℃TPU 210 50 80TPU/20PCL 210 35 70TPU/30PCL 210 35 60TPU/40PCL 210 35 PCL 100 35 Notes: The component ratios are the mass percentage. Printing speed: 20 mm/s; Layer height: 0.1 mm. 1.5 热重分析
为评估支架材料的热稳定性,分别进行热重分析测试和差示扫描量热测试。
热重分析测法(Thermogravimetry analysis,TGA):采用TGA 8000 (美国珀金埃尔默)进行测试。取7 mg样品,在氮气氛围下以30℃/min的速率从30℃升温至600℃并记录TGA热图。
差示扫描量热法(Differential scanning calorimetry,DSC):采用Mettler Toledo DSC3 (瑞士苏黎世梅特勒-托利多)进行测试。取5 mg样品,在氮气氛围下以10℃/min的速率从30℃升温至240℃。在240℃下平衡5 min以消除热力史,然后以30℃/min的速率冷却至−50℃,再二次加热至240℃。分别记录二次加热过程和冷却过程的DSC曲线。
1.6 抗迁移力
抗迁移力测试:在屠宰场(中国东莞)采集新屠宰猪的新鲜食管。如图2(a)所示,食道下端用万能试验机夹子固定,上端用两侧的绳子固定。然后,将食管支架植入猪食管内,上端打孔并用绳子系在万能拉伸机上,同时确保每次放置位置相同[26]。使用万能试验机将支架匀速拉出猪食管,终止位移设为30 mm,记录支架沿食道轴向均匀迁移过程中的最大峰值力。
1.7 径向性能
径向性能测试:采用万能试验机对每种组分比的支架进行2个样本的测试。如图2(b)所示,将支架放置在两个圆形压板之间,以10 mm/min的速度压缩,直至支架应变达到50%,记录其压缩过程的受力情况。
1.8 体外降解试验
体外降解试验:模拟支架在中性环境和极端生理环境(即人体胃内)中的降解情况。将纯PCL、纯TPU和TPU/PCL共混物浸泡在37℃的磷酸盐缓冲液(Phosphate buffer saline,PBS,pH=7.4)和模拟胃液(Simulated gastric fluid,SGF,pH=1.5)中降解8周。每2周从降解液中取出样品进行测试,并更换PBS和SGF溶液以尽可能保持pH恒定。样品用去离子水冲洗后擦去表面水分,在50℃烘箱中干燥12 h后称重,计算样品的质量损失率。样品质量损失计算如下式所示:
Mass loss = (W1−W2)W1×100% (1) 式中:W1和W2分别为初始质量和降解后的质量。
为了验证降解后支架样品的力学性能,采用前述的测试方法,对在PBS和SGF中降解期间的支架进行了径向性能测试。
1.9 体外细胞毒性试验
TPU/PCL共混物的体外细胞毒性试验:采用噻唑蓝法(Methyl thiazolyl tetrazolium,MTT)。根据标准ISO 10993-5: 2009[27],细胞存活率高于70%的样品可视为无细胞潜在毒性。
制备4组培养基:取含10vol%胎牛血清的改良培养基(Modified eagle medium,MEM)作为基础培养基即空白对照组;含二乙基二硫代氨基甲酸锌(Zinc diethyldithiocarbamate,ZDEC)提取物作为阳性对照组;含高密度聚乙烯(High density polyethylene,HDPE)作为阴性对照组;取在37℃下用10 mL的基础培养基中浸泡24 h以上的TPU/PCL共混物作为实验组。在96孔板的每一孔中分别接种100 μL基本培养基的小鼠成纤维细胞(L-929)悬液(1×105 cells/mL),24 h后将原培养基更换为空白组培养基、阴性对照组培养基、阳性对照组培养基和实验组培养基。再培养24 h后,在Multiskan SkyHigh酶标仪(美国赛默飞)上以570 nm测定光密度值。细胞存活率通过下式计算:
Cell viability= OD570eOD570b× 100% (2) 式中:OD570e 为各实验组、阳性对照组、阴性对照组的平均光密度;OD570b 为空白对照组的平均光密度。
2. 结果与讨论
2.1 聚合TPU/PCL支架制备结果
参考商业食管支架的尺寸设计TPU/PCL共混物支架,不同的是采用了全封闭的外表面代替商业食管支架的网状结构(图3(a))。有研究表明,支架两端的扩口能够提高其抗迁移力,防止支架滑落入胃[28]。因此,将支架的两端设计为扩口状,而中段设计成带周向凸肋的管状,以增强支架与食管之间的摩擦力。如图3(b)所示,支架总长为61 mm,中间部分长45 mm,直径20 mm;扩口区域长8 mm,直径28 mm;每两个周向凸肋间距5 mm,支架中段共设计有10个周向凸肋[29]。
利用这些参数通过SolidWorks 2021软件设计支架模型并导出为STL文件。再将STL文件转换成G代码文件使用颗粒式3D打印机打印支架。与最常用的线材式3D打印机相比,颗粒式3D打印机具有更快的打印速度以及更低的材料成本,同时能够打印的材料更广泛。因此更适用于共混物材料的打印(图4)。
为评估打印精度,分别测量了3D打印食管支架的高度、扩口直径和中段直径。使用游标卡尺对每个支架的直径进行5次测量,并将结果与CAD模型尺寸进行对比。结果表明,测量的平均值与标准尺寸的差值在0.03 mm以内。
2.2 TPU/PCL支架的热性能表征
所有样品的TGA图如图5所示。从PCL的热失重曲线可以看出,其起始分解温度为300℃,在450℃完全分解,这表明其热稳定性高于TPU。TPU的加入降低了TPU/PCL共混物在热分解初期的特征降解温度,这可能是由于TPU/PCL中TPU发生了分解。从失重曲线和失重速率曲线可以看出,TPU/PCL共混物具有不同的失重阶段。而TPU有不同的官能团,具有不同的分解速度,这导致样品分多阶段降解。TGA试验结果对调控3D打印喷头温度,提高打印精度具有指导意义。
为清晰显示TPU/PCL共混物的结晶度和熔点之间的差异,将图6中所有热分析图沿着按W/g缩放后的Y轴偏移。图中所示的DSC曲线分析了TPU/PCL共混物的熔融行为和结晶度。从图6(a)所示的二次加热DSC曲线可以看出,纯PCL和80TPU/20PCL样品的熔点分别为56.6℃和43.0℃,而共混物的熔点随着共混物中PCL组分的增加而升高,且峰值变高。由此可知,将TPU与PCL进行熔融共混时,TPU在一定程度上破坏了PCL的晶体结构,降低其结晶度。
从图6(b)所示样品冷却的DSC曲线可看出,TPU/PCL共混物中只存在一个结晶峰。随着共混物中PCL组分的增加,结晶峰变得更尖锐,结晶行为更明显,结晶温度趋于纯PCL。
2.3 TPU/PCL支架的力学性能结果
各组分共混物的拉伸试验应力-应变曲线如图7(a)所示。可以看出,纯TPU和TPU/PCL共混物具有形状相似的应力-应变曲线。而纯PCL的应力-应变曲线在初始阶段急剧上升,至极限应力后下降;随后经历较长时间的颈缩过程,直至最终断裂。而由图7(b)可知,纯TPU和TPU/PCL共混物的伸长率均超过520%,纯PCL的伸长率仅有189.5%。
图8则展示了各组分共混物的极限拉伸强度和拉伸模量。可以发现,纯TPU的极限拉应力为4.9 MPa。随着共混物中PCL组分比的增加,其极限拉伸强度和拉伸模量逐渐增大。纯PCL的极限拉应力为16.5 MPa,约为纯TPU的3倍。
这些结果表明,纯PCL具有较高的拉伸强度,加入少量的PCL使TPU/PCL共混物在不损失柔韧性的前提下提高了力学性能。而作为TPU/PCL共混物中组分较大的TPU则提供了共混物的弹性。
弯曲试验的主要目的是测量TPU/PCL共混物的柔韧性。各组分共混物的弯曲力学性能见表2。纯TPU的弯曲强度仅0.8 MPa,纯PCL的弯曲强度为13.9 MPa。随着PCL的加入,80TPU/20PCL的弯曲强度增至1.6 MPa,70TPU/30PCL增至2.3 MPa,60TPU/40PCL则增至3.0 MPa。结果表明,增加共混物中TPU组分可以提高共混物的柔韧性,但在一定程度上牺牲了共混物的刚性。
表 2 不同组分比TPU/PCL共混物的弯曲力学性能Table 2. Flexural mechanical properties of TPU/PCL blends with different component ratiosSample Flexural modulus/MPa Flexural strength/MPa Maximal force/N TPU 9.0±0.27 0.8±0.01 1.2±0.03 80TPU/20PCL 23.7±0.47 1.6±0.05 3.1±0.22 70TPU/30PCL 42.0±0.00 2.3±0.04 3.8±0.06 60TPU/40PCL 62.0±4.08 3.0±0.04 5.0±0.07 PCL 416.7±4.72 13.9±0.03 23.1±0.05 2.4 支架的径向力
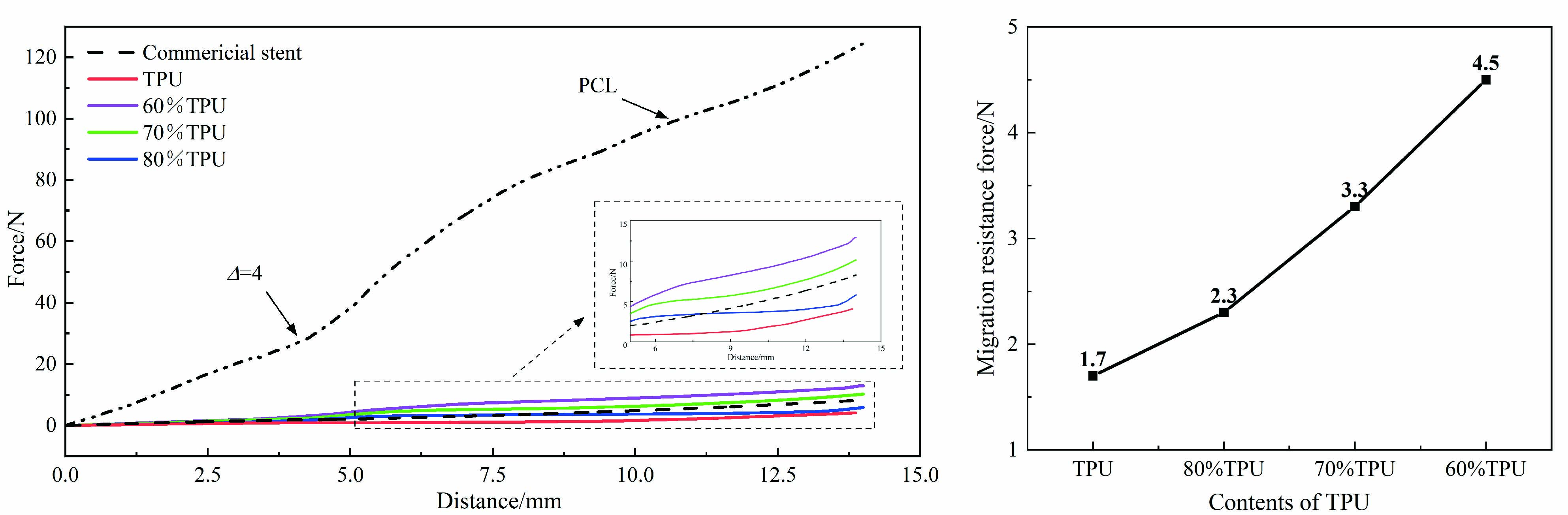
图9为各组分共混物支架和商业食管支架的径向力-位移曲线。
可以看出,当支架压缩至应变为50%时,纯TPU支架的径向力为4.1 N,80TPU/20PCL支架增至5.8 N,70TPU/30PCL支架则增至10.3 N,60TPU/40PCL进一步增至13.1 N,而纯PCL支架的径向力为124.3 N。当共混物中PCL的组分比增大时,支架的刚度更大,其抵抗变形的能力和承载能力更强,进而提升支架径向力。商业支架的径向力为8.3 N,介于70TPU/30PCL支架和80TPU/20PCL支架之间,表明共混物支架在缓解食管狭窄症状方面与商业食管支架一样有效。
纯PCL支架的径向力是商业食管支架的10倍以上,这过大的径向力会导致过高的环向张力,对食管壁造成压迫性损伤。当位移(Δ)大于4 cm时,曲线斜率增大。这是由于当Δ=0~4 cm时,压板只接触到扩口段,支架的径向力仅由扩口提供;当Δ>4 cm时,压板压缩到中间圆柱段,支架整段均有形变,导致径向力的增大速率加快。
2.5 支架的抗迁移力
将支架植入猪食管内,模拟支架在人食管内的抗迁移力。从图10观察到抗迁移力试验中有着与径向力试验相似的结果。随着PCL含量的增加,共混物支架植入后的自扩张能力越强,造成食管的变形更大。相对的,食管对支架的扩张阻力也增大,从而提高了支架的抗迁移力。增加支架的抗迁移力可以降低发生迁移的概率,从而减少与支架相关的固有并发症。但是过大的抗迁移力会增加食管穿孔的风险。
2.6 材料的体外降解
支架样品在两种降解液中降解所引起的质量和径向力变化如图11所示。纯PCL在PBS中的降解速率快于SGF,而纯TPU则相反,但差异很小。降解8周后,纯PCL支架在SGF中的质量损失为0.91%,在PBS中为1.44%;纯TPU支架在SGF中的质量损失为1.65%,在PBS中为0.99%。所有支架样品的质量损失均小于2%,外观无明显变化。同时,支架径向力基本保持不变,且结构保持完整。由此可知,TPU/PCL共混物在SGF或PBS溶液没有或仅有轻微的降解。
2.7 体外细胞活力和MTT试验结果
L-929细胞培养24 h后,分别对空白对照组、阴性对照组、阳性对照组和实验组通过镜检进行形态学评估并用中性红染色。如图12所示,空白对照组和阴性对照组的所有细胞均呈长梭形,细胞形态具有明显的片状或丝状伪足。而阳性对照组的细胞呈近乎完整的圆形裂解形态,细胞层几乎完全破坏,且观察到细胞生长抑制。MTT试验显示,空白对照组、阴性对照组和阳性对照组的细胞存活率分别为100%、84.6%和4.1%。而实验组的细胞活性为72.9%,仅观察到轻微的细胞生长抑制现象,细胞形态未发生改变。这说明共混物材料具有良好的相容性,且对细胞无潜在毒性影响。
3. 结 论
针对传统商业食管支架易引起的术后并发症和尺寸固定无法进行个性化定制的问题,本文采用双螺杆挤出机将热塑性聚氨酯(TPU)和聚己内酯(PCL)这两种不同柔韧性的共混物进行了熔融共混,并结合3D打印技术研制了一种力学性能可控的新型食管支架。在此基础上,对TPU/PCL共混物食管支架的相容性和生物力学性能进行试验分析,得到以下结论:
(1)熔融沉积(FDM)技术的3D打印速度会影响材料的力学性能,常见TPU材料的打印速度一般为40~100 mm/s。高速打印会降低材料的挤出量,导致支架成型精度低。而含PCL的打印更具困难,需采用较慢的打印速度和较低的温度以保证最佳的打印质量。较慢的打印速度为打印材料之间的粘结提供了足够的时间,从而减少层间的空隙,并提供更好的力学性能和层间结合强度[30-31],进而具备良好的共混性;
(2)热性能试验结果表明TPU/PCL共混物具有不同的失重阶段。共混物的熔点随着共混物中PCL组分的增加而升高,且峰值变高。TPU在一定程度上破坏了PCL的晶体结构,降低其结晶度。通过分析此试验结果,调控3D打印喷头的温度,可以提高打印质量;
(3) 3D打印共混物食管支架表现出良好的径向支撑和抗迁移能力。相比与性能固定的商业食管支架,3D打印TPU/PCL共混物支架可以通过调节TPU/PCL共混物的组分来调控其力学性能。因此,通过3D打印技术,可以根据患者的需求进行个性化定制性能可控、尺寸可调的食管支架。这种3D打印食管支架是由表面光滑的柔性共混物制备,降低取出和植入过程中可能造成的患者食管受损或出血的概率;
(4)因支架的降解而导致支架结构塌陷是引起食管支架并发症的原因之一[32-33]。降解试验结果表明,该共混物支架在模拟胃液(SGF)和磷酸盐缓冲液(PBS)中浸泡两个月后仍能保持完整性,并展现了持续的径向支撑性能。此外,TPU/PCL共混物具有良好的生物相容性,对细胞无潜在毒性作用;
(5) 60TPU/40PCL共混物材料展现了更为优异的拉伸性能和弯曲性能,且其制备的3D打印食管支架具有最高的径向力和抗迁移力,不仅能有效支撑食管狭窄区域,降低食管二次狭窄、支架跌落入胃等并发症发生概率,还可能避免因过大的径向力或抗迁移力而导致的食管内壁二次损伤。
本文中的大部分试验是在体外进行的,可能无法准确反映食管支架对人体的真实影响。因此,未来需要通过动物试验甚至临床试验来进一步确定3D打印TPU/PCL共混物食管支架的有效性。目前,逆向建模技术已应用于生物模型研究[34-35]。在未来的研究中,可以基于患者个体的CT影像数据,对患者的食管进行逆向建模,进而精确控制支架的结构参数,并通过数值模拟不断优化支架设计参数,进一步实现对适合患者个体的食管支架个性化定制。
-
表 1 不同组分比TPU/PCL共混物的打印参数
Table 1 Printing parameters of TPU/PCL blends with different component ratios
Sample Nozzle
temperature/℃Build plate
temperature/℃TPU 210 50 80TPU/20PCL 210 35 70TPU/30PCL 210 35 60TPU/40PCL 210 35 PCL 100 35 Notes: The component ratios are the mass percentage. Printing speed: 20 mm/s; Layer height: 0.1 mm. 表 2 不同组分比TPU/PCL共混物的弯曲力学性能
Table 2 Flexural mechanical properties of TPU/PCL blends with different component ratios
Sample Flexural modulus/MPa Flexural strength/MPa Maximal force/N TPU 9.0±0.27 0.8±0.01 1.2±0.03 80TPU/20PCL 23.7±0.47 1.6±0.05 3.1±0.22 70TPU/30PCL 42.0±0.00 2.3±0.04 3.8±0.06 60TPU/40PCL 62.0±4.08 3.0±0.04 5.0±0.07 PCL 416.7±4.72 13.9±0.03 23.1±0.05 -
[1] YANG K, CAO J, YUAN T W, et al. Silicone-covered biodegradable magnesium stent for treating benign esophageal stricture in a rabbit model[J]. World Journal of Gastroenterology, 2019, 25(25): 3207-3217. DOI: 10.3748/wjg.v25.i25.3207
[2] 贺迎, 崔永. 食管支架的研究进展[J]. 中国胸心血管外科临床杂志, 2018, 25(2): 164-170. HE Ying, CUI Yong. Advance in research of esophageal stent[J]. Chinese Journal of Clinical Thoracic and Cardiovascular Surgery, 2018, 25(2): 164-170(in Chinese).
[3] MANGIAVILLANO B, PAGANO N, ARENA M, et al. Role of stenting in gastrointestinal benign and malignant diseases[J]. World Journal of Gastrointestinal Endoscopy, 2015, 7(5): 460-480. DOI: 10.4253/wjge.v7.i5.460
[4] DIDDEN P, SPAANDER M C W, BRUNO M J, et al. Esophageal stents in malignant and benign disorders[J]. Current Gastroenterology Reports, 2013, 15(4): 319. DOI: 10.1007/s11894-013-0319-3
[5] 徐元丰, 黄优华, 沈涛, 等. 金属覆膜支架在食管癌术后食管-气管瘘的临床应用[J]. 中国卫生产业, 2014, 11(29): 133-134. XU Yuanfeng, HUANG Youhua, SHEN Tao, et al. Clinical application of metal-coated stents in postoperative esophageal-tracheal fistula after esophageal cancer surgery[J]. China Health Industry, 2014, 11(29): 133-134(in Chinese).
[6] JAIN P. Self-expanding metallic esophageal stents: A long way to go before a particular stent can be recommended[J]. World Journal of Gastroenterology, 2011, 17(48): 5327-5328. DOI: 10.3748/wjg.v17.i48.5327
[7] FIORELLI A, ESPOSITO G, PEDICELLI I, et al. Large tracheobronchial fistula due to esophageal stent migration: Let it be![J]. Asian Cardiovascular & Thoracic Annals, 2015, 23(9): 1106-1109.
[8] GROSS B C, ERKAL J L, LOCKWOOD S Y, et al. Evaluation of 3D printing and its potential impact on biotechnology and the chemical sciences[J]. Analytical Chemistry, 2014, 86(7): 3240-3253. DOI: 10.1021/ac403397r
[9] CHIA H N, WU B M. Recent advances in 3D printing of biomaterials[J]. Journal of Biological Engineering, 2015, 9(1): 4.
[10] ZHU Y Z, JORALMON D, SHAN W T, et al. 3D printing biomimetic materials and structures for biomedical applications[J]. Bio-Design and Manufacturing, 2021, 4(2): 405-428. DOI: 10.1007/s42242-020-00117-0
[11] 贾李涵, 李岩. 3D打印纳米纤维素增强聚乳酸血管支架的体外力学性能研究[J]. 复合材料科学与工程, 2021(5): 61-67. JIA Lihan, LI Yan. In vitro experimental study on the mechanical properties of vascular stents prepared by 3D printing nanocellulose/poly (lactic acid) nanocomposites[J]. Composites Science and Engineering, 2021(5): 61-67(in Chinese).
[12] YANG Y, YANG S B, WANG Y G, et al. Anti-infective efficacy, cytocompatibility and biocompatibility of a 3D-printed osteoconductive composite scaffold functionalized with quaternized chitosan[J]. Acta Biomaterialia, 2016, 46: 112-128. DOI: 10.1016/j.actbio.2016.09.035
[13] WANG X, JIANG M, ZHOU Z W, et al. 3D printing of polymer matrix composites: A review and prospective[J]. Composites Part B: Engineering, 2016, 110: 442-458.
[14] JAYSWAL A, ADANUR S. Characterization of PLA/TPU composite filaments manufactured for 3D printing with FDM[J]. Journal of Thermoplastic Composite Materials, 2023, 36(4): 1450-1471. DOI: 10.1177/08927057211062561
[15] SIDDIQUI N, ASAWA S, BIRRU B, et al. PCL-based composite scaffold matrices for tissue engineering applications[J]. Molecular Biotechnology, 2018, 60(7): 506-532. DOI: 10.1007/s12033-018-0084-5
[16] WANG Q F, MA Z Y, WANG Y, et al. Fabrication and characterization of 3D printed biocomposite scaffolds based on PCL and zirconia nanoparticles[J]. Bio-Design and Manufacturing, 2021, 4(1): 60-71. DOI: 10.1007/s42242-020-00095-3
[17] MALIKMAMMADOV E, TANIR T E, KIZILTAY A, et al. PCL and PCL-based materials in biomedical applications[J]. Journal of Biomaterials Science, Polymer Edition, 2018, 29(7-9): 863-893. DOI: 10.1080/09205063.2017.1394711
[18] FRYN P, JEWLOSZEWICZ B, BOGDANOWICZ A B, et al. Research of binary and ternary composites based on selected aliphatic or aliphatic-aromatic polymers, 5CB or SWCN toward biodegradable electrodes[J]. Materials, 2020, 13(11): 2480.
[19] 曾娇, 汪艳, 何畯涛, 等. 3D打印具有形状记忆效应的TPU/PCL复合材料研究[J]. 工程塑料应用, 2021, 49(9): 77-81. DOI: 10.3969/j.issn.1001-3539.2021.09.015 ZENG Jiao, WANG Yan, HE Juntao, et al. Research on 3D printing TPU/PCL composite material with shape memory effect[J]. Engineering Plastics Application, 2021, 49(9): 77-81(in Chinese). DOI: 10.3969/j.issn.1001-3539.2021.09.015
[20] JING X, MI H Y, HUANG H X, et al. Shape memory thermoplastic polyurethane (TPU)/poly(ε-caprolactone) (PCL) blends as self-knotting sutures[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2016, 64: 94-103. DOI: 10.1016/j.jmbbm.2016.07.023
[21] SABAHI N, ROOHANI I, WANG C H, et al. Thermoplastic polyurethane-based shape memory polymers with potential biomedical application: The effect of TPU soft-segment on shape memory effect and cytocompatibility[J]. Polymer, 2023, 283: 126189. DOI: 10.1016/j.polymer.2023.126189
[22] 王慧. FDM型打印机打印骨软骨双层支架用于骨软骨损伤修复的研究[D]. 长春: 吉林大学, 2022. WANG Hui. Research on repairing osteochondral injury with double-layer scaffolds printed by FDM printer[D]. Changchun: Jilin University, 2022(in Chinese).
[23] 李颖, 左龙, 陈宝书. 热塑性聚氨酯/聚己内酯共混物的形状记忆和力学性能[J]. 高分子材料科学与工程, 2017, 33(10): 72-75. LI Ying, ZUO Long, CHEN Baoshu. Shape memory and mechanical properties of polyurethane/polycaprolactone blends[J]. Polymer Materials Science & Engineering, 2017, 33(10): 72-75(in Chinese).
[24] International Organization for Standardization. Plastics—Determination of tensile properties—Part 2: Test conditions for moulding and extrusion plastics: ISO 527-2: 2012[S]. Geneva: ISO, 2012.
[25] International Organization for Standardization. Plastics—Determination of flexural properties: ISO 178: 2019[S]. Geneva: ISO, 2019.
[26] LIN M H, FIROOZI N, TSAI C T, et al. 3D-printed flexible polymer stents for potential applications in inoperable esophageal malignancies[J]. Acta Biomaterialia, 2019, 83: 119-129. DOI: 10.1016/j.actbio.2018.10.035
[27] International Organization for Standardization. Biological evaluation of medical devices—Part 5: Tests for in vitro cytotoxicity: ISO 10993-5: 2009[S]. Geneva: ISO, 2009.
[28] GARBEY M, SALMON R, FIKFAK V, et al. Esophageal stent migration: Testing few hypothesis with a simplified mathematical model[J]. Computers in Biology and Medicine, 2016, 79: 259-265. DOI: 10.1016/j.compbiomed.2016.10.024
[29] HINDY P, HONG J, LAM-TSAI Y, et al. A comprehensive review of esophageal stents[J]. Gastroenterology & Hepatology, 2012, 8(8): 526-534.
[30] SINGH J, PANDEY P M, KAUR T, et al. A comparative analysis of solvent cast 3D printed carbonyl iron powder reinforced polycaprolactone polymeric stents for intravascular applications[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2021, 109(9): 1344-1359. DOI: 10.1002/jbm.b.34795
[31] SINGH J, SINGH G, PANDEY P M. Multi-objective optimization of solvent cast 3D printing process parameters for fabrication of biodegradable composite stents[J]. The International Journal of Advanced Manufacturing Technology, 2021, 115(11-12): 3945-3964. DOI: 10.1007/s00170-021-07423-6
[32] RINCON O N, MADRIGAL A H, RODRIGUEZ B M, et al. Esophageal obstruction due to a collapsed biodegradable esophageal stent[J]. Endoscopy, 2011, 43: E189-E190. DOI: 10.1055/s-0030-1256324
[33] YANG K, LING C, YUAN T W, et al. Polymeric biodegradable stent insertion in the esophagus[J]. Polymers, 2016, 8(5): 158. DOI: 10.3390/polym8050158
[34] PILES L, REIG M J, JESUS SEGUI V, et al. Reverse engineering applied to biomodelling and pathological bone manufacturing using FDM technology[J]. Procedia Manufacturing, 2019, 41: 739-746. DOI: 10.1016/j.promfg.2019.09.065
[35] 施伟, 罗飞. 基于CT数据的颌骨支架材料有限元分析及3D打印模型研究[J]. 基因组学与应用生物学, 2018, 37(10): 4553-4559. SHI Wei, LUO Fei. Research on finite element analysis of jaw bone scaffold materials and the 3D printing model based on CT data[J]. Genomics and Applied Biology, 2018, 37(10): 4553-4559(in Chinese).
-
其他相关附件
-
目的
食管支架在食管疾病的临床治疗中有广泛的应用。但商业食管支架尺寸固定,无法根据患者食管的几何形状进行个性化定制。随着3D打印技术的快速发展,3D打印技术在制造生物材料和个性化定制医疗器械方面展现显著优势。本文利用3D打印技术制备一种新型的热塑性聚氨酯(TPU)/聚己内酯(PCL)共混物食管支架,探索不同组分比的TPU/PCL共混物及其制备的3D打印食管支架的相容性和力学性能。
方法通过熔融共混结合3D打印技术的方式制备一种热塑性聚氨酯(TPU)/聚己内酯(PCL)共混物食管支架,并基于对TPU/PCL共混物组分比例的调节,实现对支架力学性能的调控。通过差示扫描量热(DSC)、热重分析(TGA)、力学试验、体外降解试验和细胞毒性检测研究了TPU/PCL共混物的理化特性及支架的各项关键指标。
结果各体外试验结果表明,TPU/PCL共混物及其制备的食管支架具有良好的相容性和力学性能:①通过3D打印的食管支架尺寸与CAD模型标准尺寸的差值在0.03 mm以内。②PCL的热稳定性高于TPU,TPU的加入降低了TPU/PCL共混物在热分解初期的特征降解温度,使得TPU/PCL共混物具有不同的失重阶段。同时,TPU/PCL共混物的熔点随着共混物中PCL组分的增加而升高,且峰值变高。随着共混物中PCL组分的增加,结晶峰变得更尖锐,结晶行为更明显,结晶温度趋于纯PCL。③纯TPU和TPU/PCL共混物具有形状相似的应力-应变曲线。纯TPU和TPU/PCL共混物的伸长率均超过520%,纯PCL的伸长率仅有189.5%。随着共混物中PCL组分比的增加,其极限拉伸强度和拉伸模量逐渐增大。纯PCL具有较高的拉伸强度,加入少量的PCL使TPU/PCL共混物在不损失柔韧性的前提下提高了力学性能。而作为TPU/PCL共混物中组分较大的TPU则提供了共混物的弹性。增加共混物中TPU组分可以提高共混物的柔韧性。④当TPU/PCL共混物中PCL的组分比增大时,支架的刚度更大,其抵抗变形的能力和承载能力更强,进而提升支架径向力。TPU/PCL共混物支架在缓解食管狭窄症状方面与商业食管支架一样有效。⑤随着TPU/PCL共混物中PCL含量的增加,共混物支架植入后的自扩张能力越强,造成食管的变形更大。相对的,食管对支架的扩张阻力也增大,从而提高了支架的抗迁移力。⑥降解8周后,所有支架样品的重量损失均小于2%,外观无明显变化。同时,支架径向力基本保持不变,且结构保持完整。TPU/PCL共混物在SGF或PBS溶液没有或仅有轻微的降解。⑦TPU/PCL共混物实验组的细胞活性为72.9%,仅观察到轻微的细胞生长抑制现象,细胞形态未发生改变。共混物材料具有良好的生物相容性,且对细胞无潜在毒性影响。
结论3D打印食管支架具有较高的精度,TPU/PCL共混物具有良好的相容性,且对细胞无潜在毒性影响。3D打印TPU/PCL共混物食管支架具有良好的径向支撑和抗迁移能力,降低术后并发症发生的概率。与尺寸和性能固定的商业食管支架相比,3D打印TPU/PCL共混物支架可以通过调节TPU/PCL共混物的组分来调控其力学性能。因此,通过3D打印技术,可以根据患者的需求进行个性化定制尺寸可调、性能可控的TPU/PCL共混物食管支架,在食管狭窄的临床个性化治疗中具有潜在应用前景。
-
在临床上,使用食管支架治疗各种食管疾病是一种有效的方法。目前,镍钛合金自膨胀式金属支架因其具有较好的力学性能和可压缩性被广泛用于缓解恶性吞咽困难。但自膨胀式金属支架在手术的早期或晚期会引起肿瘤组织长入、出血、狭窄复发、穿孔、反流疾病、支架滑落入胃等并发症,造成患者不适,影响治疗效果。而随着3D打印技术的快速发展,医疗领域对个性化定制人工器官和医疗器械的需求日益增长。
本文通过熔融共混结合3D打印技术的方式制备了一种热塑性聚氨酯(TPU)/聚己内酯(PCL)共混物食管支架。它不仅可以基于对TPU/PCL共混物组分比例的调节,实现对支架力学性能的调控,使患者有更多的治疗选择,同时在不对食管壁施加过大应力的情况下,提供更优异的抗迁移性能并保持食管持续通畅。TPU/PCL共混物具有良好的材料相容性和生物力学性能,加入少量PCL能使TPU/PCL共混物在不损失柔韧性的前提下提高力学性能。随着PCL含量增加,支架的抗迁移力增大,进而降低支架迁移的概率。而作为TPU/PCL共混物中的组分较大的TPU提供了食管支架柔韧性。商业食管支架的径向力介于70TPU/30PCL和80TPU/20PCL共混物支架之间,表明了共混物支架在缓解食管狭窄症状方面与商业支架一样有效。经过为期8周的体外降解试验,3D打印TPU/PCL共混物食管支架的重量损失均小于2%,且力学性能无明显变化。此外,TPU/PCL共混物的细胞活性为72.9%,对细胞无潜在毒性。3D打印TPU/PCL共混物支架优越的力学和生物学性能证明了其在食管狭窄的临床个性化治疗中具有潜在应用前景。
(a) 不同组分的3D打印TPU/PCL共混物食管支架与商用食管支架的径向力-位移曲线的对比(b) 不同组分的3D打印TPU/PCL共混物食管支架的抗迁移力





 下载:
下载:











