Study on adsorption effect and mechanism of uranium by hydroxyapatite modified bentonite
-
摘要: 伴随我国核能的开发与高效利用,铀已成为我国地表水、地下水和土壤的常见污染物之一,从含铀废水中去除U(VI)已成为亟需解决的环境问题。本工作以膨润土(BTN)、磷酸氢二钠、硝酸钙为原料,采用简单易行的一步水热法成功制备出羟基磷灰石(HAP)改性膨润土复合材料(HAP/BTN)。考察了HAP/BTN对水溶液中铀的吸附性能,利用单因素试验和正交试验探讨了pH、转速、温度、投加量、时间对吸附性能的影响。试验结果表明,在pH=6.0、转速=100 r·min−1、室温(298.15 K)、HAP/BTN投加量1 g·L−1、吸附时间t=30 min时,该吸附材料对10 mg·L−1含铀废水的去除率可达98%,最大吸附量为186.45 mg·g−1。吸附过程更符合Langmuir模型和准二级动力学,热力学参数表明HAP/BTN对铀的吸附是自发吸热的过程,结合XPS及XRD的结果证实了HAP/BTN吸附铀主要归因于络合反应、化学吸附、静电吸附和离子交换作用。Abstract: With the development and efficient utilization of nuclear energy in China, uranium has become one of the common pollutants in surface water, groundwater and soil. The removal of U(VI) from uranium-containing wastewater has become an urgent environmental problem to be solved. Hydroxyapatite modified bentonite composite hydroxyapatite modified bentonite (HAP/BTN) was successfully prepared by a simple one-step hydrothermal method using bentonite, disodium hydrogen phosphate and calcium nitrate as raw materials. The adsorption performance of HAP/BTN on uranium in wastewater was investigated. The effects of pH, rotation speed, temperature, dosage and time on the adsorption performance were discussed by orthogonal test. The results showed that under the conditions of pH=6.0, rotation speed=100 r·min−1, room temperature (298.15 K), HAP/BTN dosage of 1 g·L−1 and adsorption time t=30 min, the removal rate of 10 mg·L−1 uranium-containing wastewater could reach 98%, and the maximum adsorption capacity was 186.45 mg·g−1. The adsorption process was more in line with the Langmuir model and pseudo-second-order kinetics. Thermodynamic parameters show that the adsorption of uranium on HAP/BTN was a spontaneous endothermic process, combined with XPS and XRD results, confirmed that the adsorption of uranium by HAP/BTN was mainly attributed to complexation reaction, chemical adsorption, electrostatic and ion exchange.
-
Keywords:
- bentonite /
- hydroxyapatite /
- uranium wastewater /
- adsorption /
- U(VI)
-
世界环境污染问题日趋严重,其中有机废水污染对人类健康和环境构成了极大的威胁[1-2]。光催化技术作为一种高效、安全的环境友好型净化技术,被广泛应用于降解环境中的有机污染物,具有广阔的应用前景[3-6]。
TiO2是众多光催化材料中最具有潜力的,因其无毒、稳定、廉价、可循环利用等优点而得到广泛的研究和商业应用[7-9],但是TiO2存在低表面积、禁带宽、电子空穴对复合率高、光吸收能力低等问题限制了它的光催化性能[10-11]。为此,研究者们提出了多种方法来提高TiO2的光催化性能,如贵金属掺杂[12]、非金属元素掺杂[13-14]、稀土或过渡金属掺杂、构建异质结等[15-16]。结果表明,经复合改性后的TiO2催化效率均有不同程度的提高[17]。但是,制备一种禁带宽度小、光吸收范围大、光生电子还原能力强的基于TiO2的光催化复合材料仍然是一个关键挑战[18]。在众多改性方法中,构建异质结是较有效的方法[19]。相比于成本较高的贵金属等催化材料,碳材料具有特殊的结构和形态,而在不同结构的碳材料中,空心碳球(HCS)为独特的中空结构[20],具有比表面积大、亲水性好、化学稳定性高、热稳定性高、密度低等特点[21]。
本文基于HCS与TiO2两者之间可以通过氢键和范德华力,形成HCS@TiO2范德华异质结,HCS作为导电基板的引入,提高了光生电子对从TiO2中的分离效率[22],高比表面积和良好的亲水性增大了TiO2与染料的接触面积[23]及对染料颗粒的吸附性能,使染料被高效地光催化降解,同时具有优异的重复使用性和广谱性,为光催化降解有机染料的复合材料的设计和制备提供了一条新的途径。通过简单的湿化学法制备了HCS@TiO2光催化复合材料,探索了在模拟太阳光下光催化降解活性红195 (RR195)的光催化性能。通过SEM、TEM、XRD、XPS、TG、N2吸附-脱附曲线、接触角测试对其进行形貌与结构的表征;通过紫外-可见吸收光谱(UV-Vis DRS)、Mott-Schottky测试分析其光学特性;通过UV-Vis DRS、电化学阻抗谱(EIS)测试、瞬态光电流响应图和循环降解试验分析其光催化降解性能,同时对HCS@TiO2光催化复合材料的光催化机制进行了探究,结合自由基捕获实验、电子顺磁共振波谱(ESR)表征的方法提出了HCS@TiO2光催化复合材料的光催化降解机制。
1. 实验材料及方法
1.1 原材料
活性红195,工业级,浙江龙盛化工研究有限公司;乙酰丙酮钛、吡咯、过硫酸铵、硝酸、氢氧化钠、硫酸、无水乙醇,分析纯,均购自国药集团化学试剂有限公司。
1.2 HCS@TiO2复合材料的合成
HCS的制备:采用乳液聚合法[24]合成了聚苯乙烯(PS)纳米球。PS母液(1 mg·mL−1,2 mL)作为模板,分散在去离子水(100 mL)中,搅拌10 min,然后,向溶液中加入吡咯单体(0.2 mL)的同时逐滴添加过硫酸铵(0.13 g,30 mL),反应4 h,将沉淀物过滤并用水和乙醇洗涤数次,所得产物记为PS@聚吡咯(PPy)。最后,将PS@PPy在5℃·min−1的加热速率下从20℃碳化至850℃,并在氩气(Ar)流下保持2 h,得到HCS。
HCS的酸化处理:将制备的HCS加入体积比为1∶3的H2SO4/HNO3混合物中,在60℃下搅拌24 h。然后过滤沉淀用水和乙醇洗涤数次,直至pH值达到7.0。接着在70℃下真空干燥酸化的HCS。
HCS@TiO2复合材料的制备:将HCS (5 mg)加入到无水乙醇(4 mL)和去离子水(1 mL)的混合物中。在超声波作用下持续振荡0.5 h至形成黑色悬浮液。然后,在HCS悬浮液中加入乙酰丙酮钛(50 mg),搅拌24 h,去除残留溶剂;所得产物记为HCS@二氧化钛前驱体(TOAC)。然后,将一定数量的HCS@TOAC (质量比1∶10)在空气气流下以350℃碳化1 h,然后在Ar气流下以5℃·min−1的加热速率加热至650℃,保温2 h。冷却至室温后,经后处理得到HCS@TiO2。采用不同煅烧温度(250℃、300℃、350℃、550℃、650℃)可制备不同煅烧温度下的HCS@TiO2复合材料。图1为HCS@TiO2复合材料的合成示意图。
1.3 样品表征
采用Gemini 300扫描电镜(德国蔡司)、Tecnai G2F20 200 kV场发射透射电子显微镜(美国FEI公司)分析光催化复合材料的整体形貌和结构。利用Philips X'pert PRO X射线衍射仪(荷兰帕纳科公司)分析了煅烧温度和煅烧气流对TiO2结晶度的影响。以MgKα为X射线源在Shimadzu ESCA-3400型 X 射线光电子能谱仪(宁波欧普仪器有限公司)上对样品进行XPS测量。采用ASAP 2020 比表面与孔隙度分析仪(麦克仪器),在77 K下以N2为吸附剂测得样品的N2吸附-脱附等温线,并利用BET方程计算其表面积。采用TGA400型热重分析仪(珀金埃尔默),在空气下,温度范围为30~650℃,对样品进行热重(TG)分析,加热速率为10℃·min−1。通过接触角测试分析样品的亲疏水性能。采用TU-1901 UV-Vis 分光光度计(普析)测试样品的漫反射光谱,以BaSO4为参比,扫描范围为200~600 nm。在上海辰华CHI660 E 电化学工作站上测量制备的复合材料的电化学阻抗谱、瞬态光电流响应图和Mott-Schottky曲线,测试条件:三电极系统(对电极:铂电极;参比电极:银/氯化银电极;工作电极:氧化铟锡(Indium tin oxide,ITO);底液:0.1 mol/L硫酸钠溶液;偏压:0 V;光源:氙灯(> 420 nm),光电流测试光照时间间隔为5 s (开灯5 s,关灯5 s),进行14个循环,EIS测试频率范围为0.1 Hz~100 kHz,Mott-Schottky曲线测试范围为−0.4~0.8 V,频率为500、1000、1500 Hz。采用EMX-8 spectrometer电子顺磁共振波谱仪(德国布鲁克公司)测试反应体系中自由基和光生电子空穴。测试方法:取适量光催化剂分散到含有四甲基哌啶(TEMPO)的甲醇溶液中,超声3 min使其均匀分散,然后打开氙灯,光照2 min后,放入仪器中进行检测e−。
1.4 光催化性能测试
以RR195为实验对象,测试制备的HCS@TiO2复合材料的光催化性能,同时分析各种样品对浓度为20 mg/L (100 mL)的RR195溶液的降解率,验证HCS和TiO2之间是否存在协同效应。另外,利用HCS@TiO2复合材料分别对RR195、活性黑5 (RB5)和碱性蓝9 (MB)进行光催化降解,验证复合材料的广谱性。在进行光催化降解RR195的实验之前,使用H2SO4/NaOH ±(0.5 mol/L)将染料废水的pH调整到3~11 (±0.1)。然后,将复合材料(10 mg)加入到100 mL的RR195溶液中。超声分散后,在黑暗中搅拌30 min达到吸附平衡。然后打开氙气灯(250 W,输出波长290~800 nm),开始光催化反应。光反应开始后,以给定的时间间隔,取约4 mL的悬浮液,离心(4000 r/ min,3 min)去除光催化剂,然后使用UV-Vis分光光度计进行测试,在543 nm处分析残留染料浓度,计算其降解率,如下式所示:
D=C0−CtC0×100% (1) 其中:D为降解率;C0为染料初始浓度;Ct为时间t的染料浓度。
2. 结果与讨论
2.1 HCS@TiO2的形貌和结构分析
为了观察光催化复合材料的形貌,通过SEM、TEM对TiO2和HCS@TiO2进行表征,结果如图2所示。由图2(a)和图2(b)可以看出,HCS为规整光滑、尺寸均匀的中空球体,粒径约为200 nm。图2(c)可以看出TiO2 均匀地负载在HCS上,且HCS负载TiO2后仍保持球形结构,稳定性好。图2(d)可以看出该材料没有出现TiO2纳米颗粒聚集的现象。图2(e)的C、N (来自吡咯衍生物)、O、Ti元素的映射图说明TiO2纳米颗粒分布在HCS表面。图2(f)可以观察到无定形碳包围着TiO2晶格条纹,其晶格间距为0.352 nm,对应锐钛矿型TiO2的(101)晶面[25],图2(g)也证实了晶面间距为0.352 nm。
通过XRD分析煅烧温度和煅烧气流对TiO2结晶度的影响,结果如图3和图4所示。图3为Ar气流下650℃煅烧制备HCS@TiO2的XRD图谱,其中TiO2的衍射峰不尖锐,晶体结构不够规整。图4为不同煅烧温度下制备HCS@TiO2的XRD图谱,TiO2的衍射峰与锐钛矿型TiO2 (JCPDS No. 21-1272) 和金红石型TiO2 (JCPDS No. 21-1276)相匹配良好,表明在空气中650℃煅烧得到的TiO2是一种双晶结构[26-27]。HCS在空气气流下400℃左右碳化时,其骨架开始坍塌,HCS@TiO2需先在O2气流中煅烧,后在Ar气流下进行煅烧。将不同煅烧温度下的HCS@TiO2的XRD进行分析对比,可得HCS@TiO2 350℃(O2)-650℃(Ar)的锐钛矿型衍射峰最强,说明晶体结构最规整,在2θ=25.2°、37.8°、48.0°、53.8°、55.0°和62.6°处的特征衍射峰与锐钛矿相的(101)、(004)、(200)、(105)、(211)、(204)晶面对应,而锐钛矿型TiO2具有比金红石型TiO2更优异的光催化性能[28]。
此外,在不同热解温度(O2和Ar气流)下制备的HCS@TiO2在TiO2相同的2θ位置上出现衍射峰,表明HCS对TiO2晶体结构的影响可以忽略不计。
图5为TiO2、HCS及HCS@TiO2的XPS全谱图,可以看出HCS@TiO2在284.8 eV、459.4 eV和530.0 eV的位置存在C1s峰、Ti2p峰和O1s峰,表明HCS@TiO2中仅存在C、O和Ti元素,没有被污染。
图6为样品不同元素的高分辨XPS光谱。图6(a)和图6(b)分别为HCS和HCS@TiO2在C1s区域的高分辨XPS光谱,可以看出HCS的C1s XPS有3个特征峰,对应C=C、C—C和O—C=O键,分别位于284.4 eV、285.2 eV和288.3 eV处,而在HCS@TiO2中观察到两个处于283.3 eV(C—Ti)和286.1 eV(C=O)的新峰,说明HCS和TiO2之间有很强的相互作用,且前3个峰均呈轻微的负位移。由TiO2和HCS@TiO2的O1s高分辨XPS光谱(图6(c)、图6(d))可以看出,TiO2在529.5 eV和530.8 eV处显示的两个特征峰,属于Ti—O—Ti和Ti—OH键。与TiO2相比,HCS@TiO2的O1s XPS中的两个特征峰发生了负位移。在TiO2和HCS@TiO2的Ti2p高分辨XPS光谱(图6(e)、图6(f))中,TiO2的Ti2p3/2和Ti2p1/2[29]的结合能分别为458.2 eV和463.9 eV,而HCS@TiO2的Ti2p3/2和Ti2p1/2峰值信号与TiO2相比,向上移动了约0.5 eV,可能是TiO2和HCS之间形成C—Ti的原因。基于上述说明TiO2成功锚定在HCS上。
TiO2和HCS@TiO2的N2吸附-脱附等温线如图7所示,两种材料均为IV型等温线,表明两种材料中均存在大孔或介孔,TiO2等温线中存在H3型磁滞回环,而HCS@TiO2的滞回环类型变为H1型,这归功于HCS具有大量孔隙。根据BET方程计算得出,TiO2和HCS@TiO2的比表面积分别为19.6 m2/g和91.1 m2/g,表明HCS的加入,大大增加了HCS@TiO2的比表面积,减少了TiO2的团聚。
为了测试HCS@TiO2的定量组分和热稳定性,采用TGA对HCS@TiO2的热稳定性进行了研究,结果如图8所示。
可以看出,样品发生两次明显的质量损失。第一次质量损失是样品在100℃以下损失2.4wt%,主要归因于物理吸附和水的蒸发;第二次质量损失是样品在400℃以上损失17.2wt%,主要归因于燃烧HCS去除碳框架。最后,在600℃以上保持在80wt%不变。因此,确定HCS@TiO2中TiO2的质量分数为80wt%,具有优异的热稳定性。
通过接触角测试,分析HCS、酸化后的HCS、TiO2、HCS@TiO2的亲疏水性能,测试结果如图9所示,HCS、酸化后的HCS、TiO2、HCS@TiO2的接触角分别为135°、38°、85°和55°。HCS为疏水性材料,经过强酸酸化后,接触角明显减小了,说明酸化使HCS表面引入了大量极性基团,使其具有优异的亲水性和分散性。TiO2的接触角为85°,易发生团聚现象。与TiO2相比,HCS@TiO2的亲水性得到了明显提升,利于染料的吸附。
2.2 HCS@TiO2的光学特性
TiO2和HCS@TiO2的紫外-可见吸收光谱如图10(a)所示。可以看出,TiO2的吸收边带在390 nm左右,而HCS@TiO2的吸收边带发生了红移,在450 nm左右。
采用公式
(αhv)n=A(hv−Eg) (2) 其中:α为吸光度;h为普朗克常数;v为频率;指数n与半导体类型直接相关;A为比例常数;Eg为半导体的能隙,可以计算得到TiO2和HCS@TiO2的能量间隙图,利用切线法较精确地得到TiO2和HCS@TiO2复合材料的带隙能图,如图10(b)所示,TiO2的带隙能为3.13 eV,而HCS@TiO2的带隙能为2.83 eV,即HCS@TiO2的带隙能降低了,对光吸收范围更大了。
对TiO2和HCS@TiO2进行了Mott-Schottky测试,结果如图11所示。样品的曲线斜率均为正,这说明TiO2和HCS@TiO2均为n型半导体;且HCS@TiO2的斜率明显小于TiO2的斜率,表明HCS@TiO2的载流子浓度比TiO2的载流子浓度高。
2.3 HCS@TiO2复合材料的光催化降解染料性能
通过EIS研究TiO2和HCS@TiO2的电荷转移效率,结果如图12(a)所示。可以看出,HCS@TiO2的圆弧半径明显小于TiO2,说明其电荷转移电阻较低,促进电荷转移的同时抑制光生电子空穴对的复合,有利于光催化性能的提高[30]。图12(b)展示了HCS@TiO2和TiO2在可见光下反复开/关时的瞬态光电流,两种材料均展示出快速可逆的瞬态光电流响应,且随着光照时间的增强,光电流密度没有明显的衰减,同时,HCS@TiO2的光电流密度明显高于TiO2。表明HCS@TiO2的光生电子空穴对复合率更低,为光催化过程中提供稳定数量的光生电子[6]。
图13为HCS、TiO2 和HCS@TiO2这3种材料对RR195的降解曲线图,图14为HCS@TiO2光催化降解RR195、RB5和MB的曲线图。由图13可以看出,在暗箱吸附30 min 后,HCS的吸附达到平衡,之后一直保持不变;光照120 min后,TiO2降解率为62.93%,而HCS@TiO2降解率为95.36%,这是由于HCS和TiO2之间存在协同效应,提高了光生电子空穴对的分离效率,加速了污染物的降解。由图14可以看出,HCS@TiO2在光照120 min内对3种不同结构染料的降解率均高达95.00%,故HCS@TiO2具有广谱性。
图15为HCS@TiO2降解RR195的紫外-可见光吸收光谱图及降解过程中的染液颜色变化图。可以看出,反应初始,RR195在510 nm和543 nm处均出现了吸收峰,对应—N=N—。随着反应的进行,RR195的颜色由艳红逐渐变为无色,最大吸收峰逐渐降低,说明其发色基团被有效降解。另外,为了考察HCS@TiO2的可重复利用性,进行了5次降解RR195的循环实验,每个循环周期都要进行30 min的暗箱吸附和120 min的光降解,结果如图16所示。可以看出,该复合材料5次循环后,降解率为93.34%,依旧保持很高的光催化活性,这归因于其本身独特的3D球形结构,可以防止负载在HCS上的TiO2掉落。另外,降解后,HCS@TiO2的回收率可达91.30%。
2.4 HCS@TiO2的光催化降解机制
为了研究光催化降解中起主要作用的活性物质,采用苯醌(BQ)、乙二胺四乙酸钠(EDTA-2Na)和异丙醇(IPA)分别作为•O−2、h+和•OH的捕获试剂,结果如图17所示。
可以看出,在反应体系中加入捕获试剂后,光催化降解效率都会受到不同程度的抑制。其中加入BQ后,光催化效率下降最明显,降解率为49.83%,说明•O−2在光催化反应体系中起主要作用;而加入EDTA-2Na和IPA,降解率分别为83.50%和89.67%,说明h+和•OH在光催化反应体系中起次要作用,由此说明3种自由基的降解效率,•O−2最高,h+次之,•OH最低。可以推断,RR195可能在紫外照射下主要被•O2 −和h+分解。
为了进一步探究光催化机制,通过ESR研究了自由基产生和转移机制,结果如图18所示。由于四甲基哌啶(TEMPO)作为电子e−的自旋标记分子,能够被检测到信号强度为1∶1∶1的信号峰,信号峰越弱,表明该样品生成的光生电子越多。可以看出,0 min即不光照时,TiO2的信号强度低于HCS@TiO2的信号强度;辐照10 min后,TiO2和HCS@TiO2的信号强度均有所减弱,且HCS@TiO2信号强度明显低于TiO2的信号强度,这是由于HCS作为电子陷阱促进了电子的转移,提高了光生电子空穴对的分离效率,因而HCS@TiO2相比于TiO2可以生成更多的光生电子。
基于上述实验结果与分析,提出了HCS@TiO2复合材料光催化活性增强机制,如图19所示。由图可以看出:在光照下,e−从TiO2的价带(VB)跃迁到导带(CB)上,HCS功函高于TiO2,e−从TiO2的CB转移到HCS表面;TiO2上的h+会与H2O发生反应生成•OH;HCS表面的e−会与O2发生反应,使其生成•O−2,O−2还会与H+反应,生成过氧化氢自由基(H2O•),H2O•是H2O2的前躯体,后续反应生成H2O2,氧化反应和还原反应分别在TiO2和HCS上进行。此外,HCS的高比表面积可以使TiO2均匀负载,改善TiO2团聚现象,增加吸附点和活性位点,提高反应体系的降解速率。
3. 结 论
(1)利用简单的湿化学法可以制备空心碳球(HCS)@TiO2光催化复合材料,且TiO2均匀负载在HCS上,形成亲水性强、比表面积大、热稳定性优异的球形复合材料。
(2)光电化学性质分析表明,HCS@TiO2比TiO2禁带宽度更小,光响应范围更大,光生电子还原能力更强。
(3) HCS和TiO2之间的协同效应,提高了光生电子空穴对的分离效率,加速了污染物的降解。相同条件下,TiO2降解率仅为62.93%,而HCS@TiO2的降解率为95.36%,5次循环后降解率为93.34%,回收率为91.30%,且具有广谱性。
(4) 结合自由基捕获实验及电子顺磁共振光谱,提出了HCS@TiO2光催化复合材料的光催化降解机制,证实了•O−2在光催化反应体系中起主要作用。
-
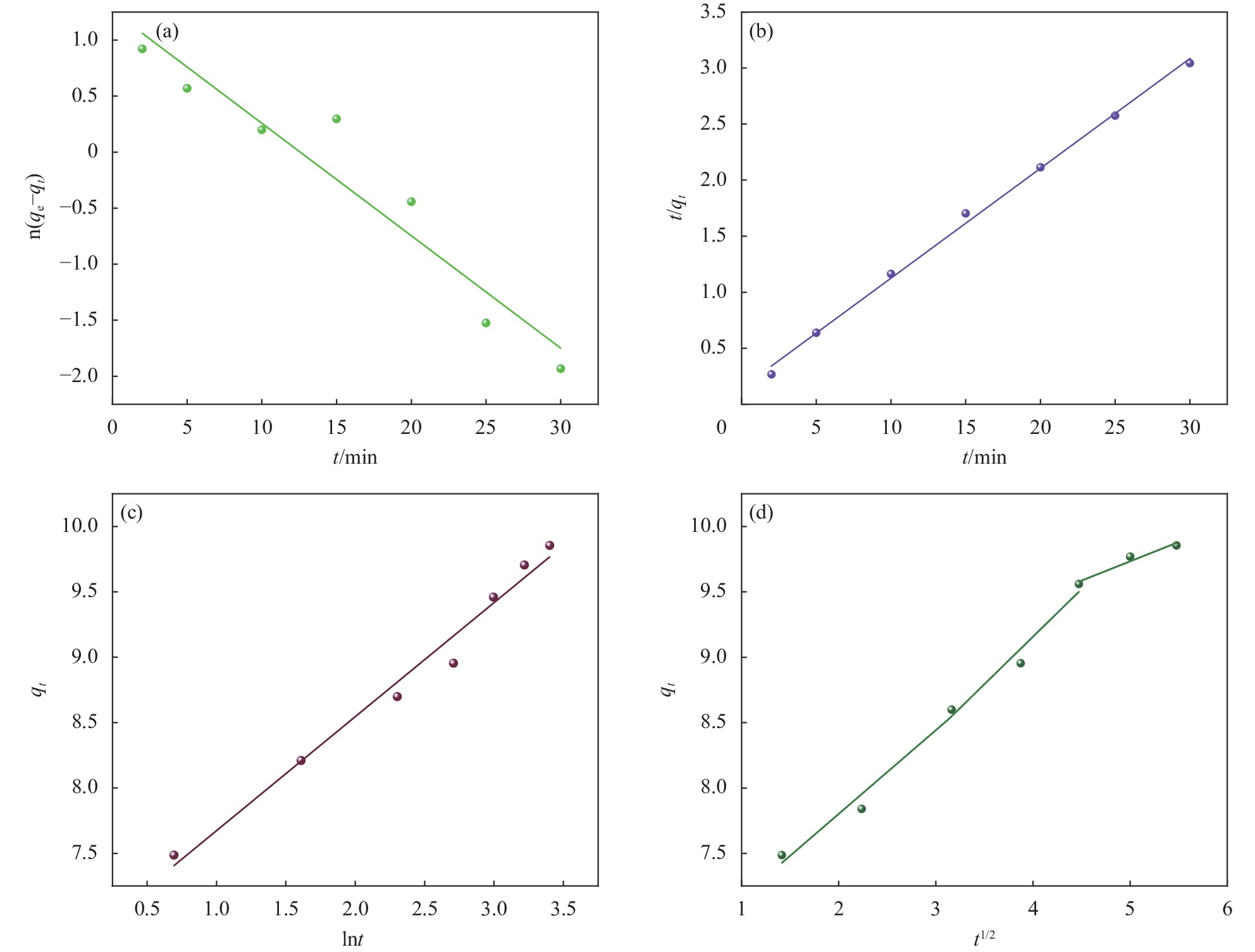
图 13 HAP/BTN吸附铀的动力学研究:准一级动力学 (a)、准二级动力学 (b)、Elovich动力学 (c)、Morrist颗粒内扩散模型 (d)
Figure 13. Kinetic study of uranium adsorption on HAP/BTN: Quasi-first-order kinetics (a), Quasi-second-order kinetics (b), Elovich kinetics (c), Morrist intraparticle diffusion model (d)
qt—Adsorption capacity at time t; qe—Equilibrium adsorption capacity
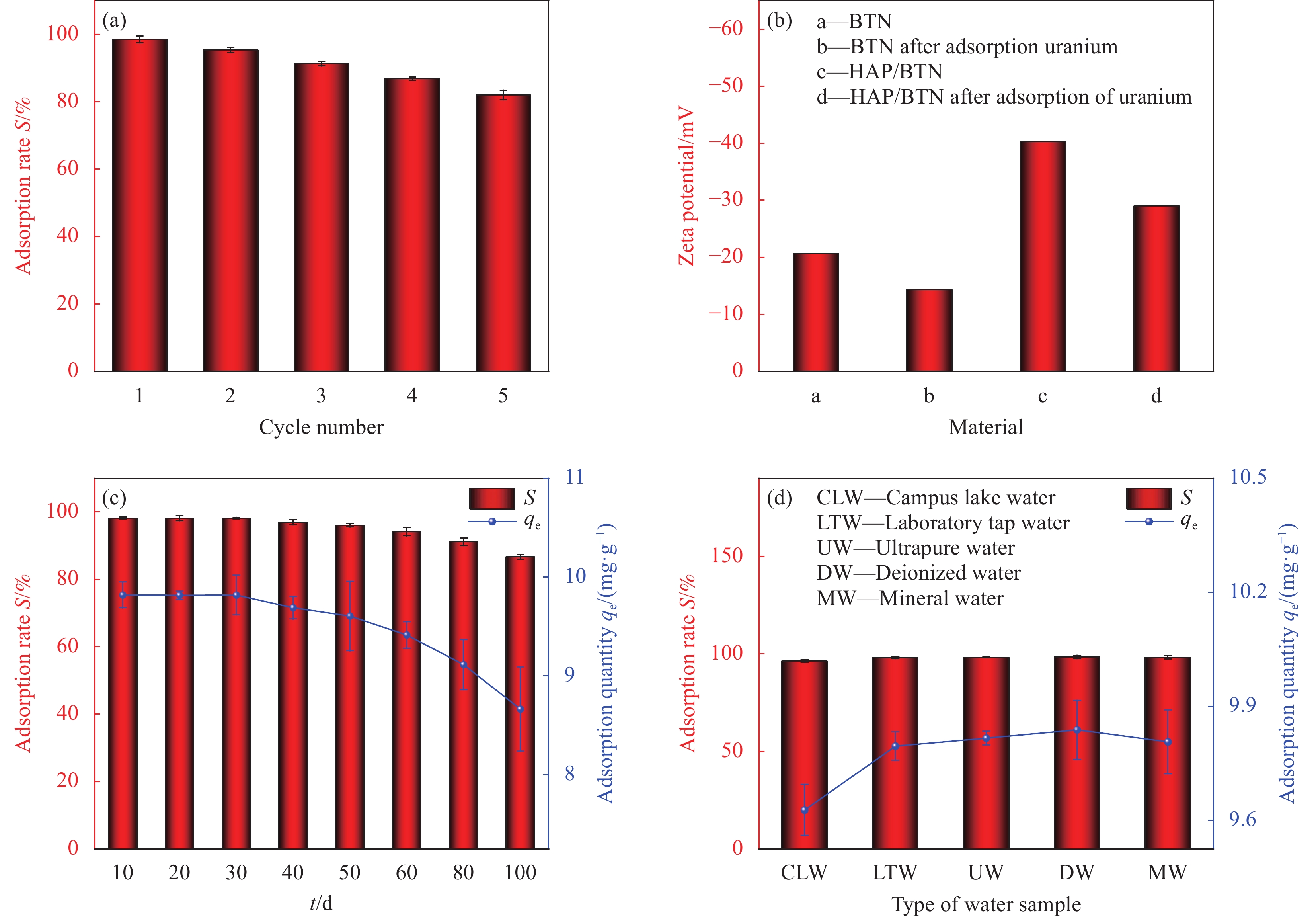
图 15 HAP/BTN循环试验 (a)、BTN或HAP/BTN吸附铀前/吸附后的Zeta电位值 (b)、吸附时间对HAP/BTN吸附铀稳定性的影响 (c)、不同水样稀释对HAP/BTN吸附铀的影响(pH=6.0、R=100 r·min−1、T=298.15 K、m=1 g·L−1、V=50 mL、t=30 min) (d)
Figure 15. HAP/BTN cycle test (a), Zeta potential values of BTN or HAP/BTN before and after adsorption (b), effect of time on the stability of HAP/BTN (c), effect of different water samples on H (pH=6.0, R=100 r·min−1, T=298.15 K, m=1 g·L−1, V=50 mL, t=30 min) (d)
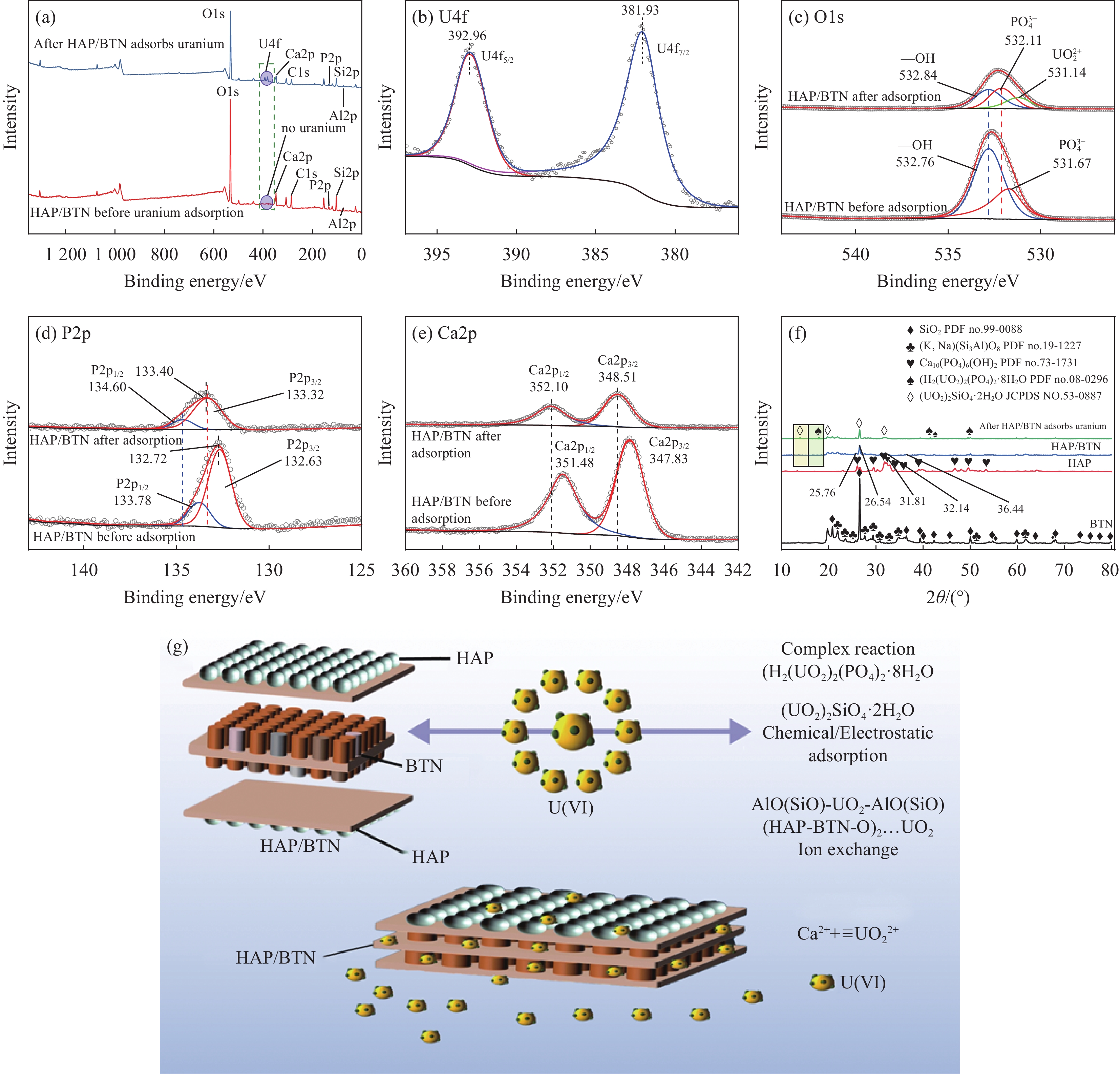
图 17 ((a), (c)~(e)) HAP/BTN吸附铀前后的XPS分析;(b)铀的精细谱;(f) BTN、HAP、HAP/BTN及HAP/BTN吸附铀后的XRD图谱;(g) HAP/BTN吸附铀的机制
Figure 17. ((a), (c)-(e)) XPS analysis before and after adsorption of uranium; (b) Fine spectrum of uranium; (f) XRD patterns of BTN, HAP, HAP/BTN and after HAP/BTN adsorbs uranium; (g) Adsorption mechanism of HAP/BNT
表 1 HAP/BTN吸附铀的正交试验因素及水平设计
Table 1 Orthogonal test factors and level design of HAP/BTN adsorption of uranium
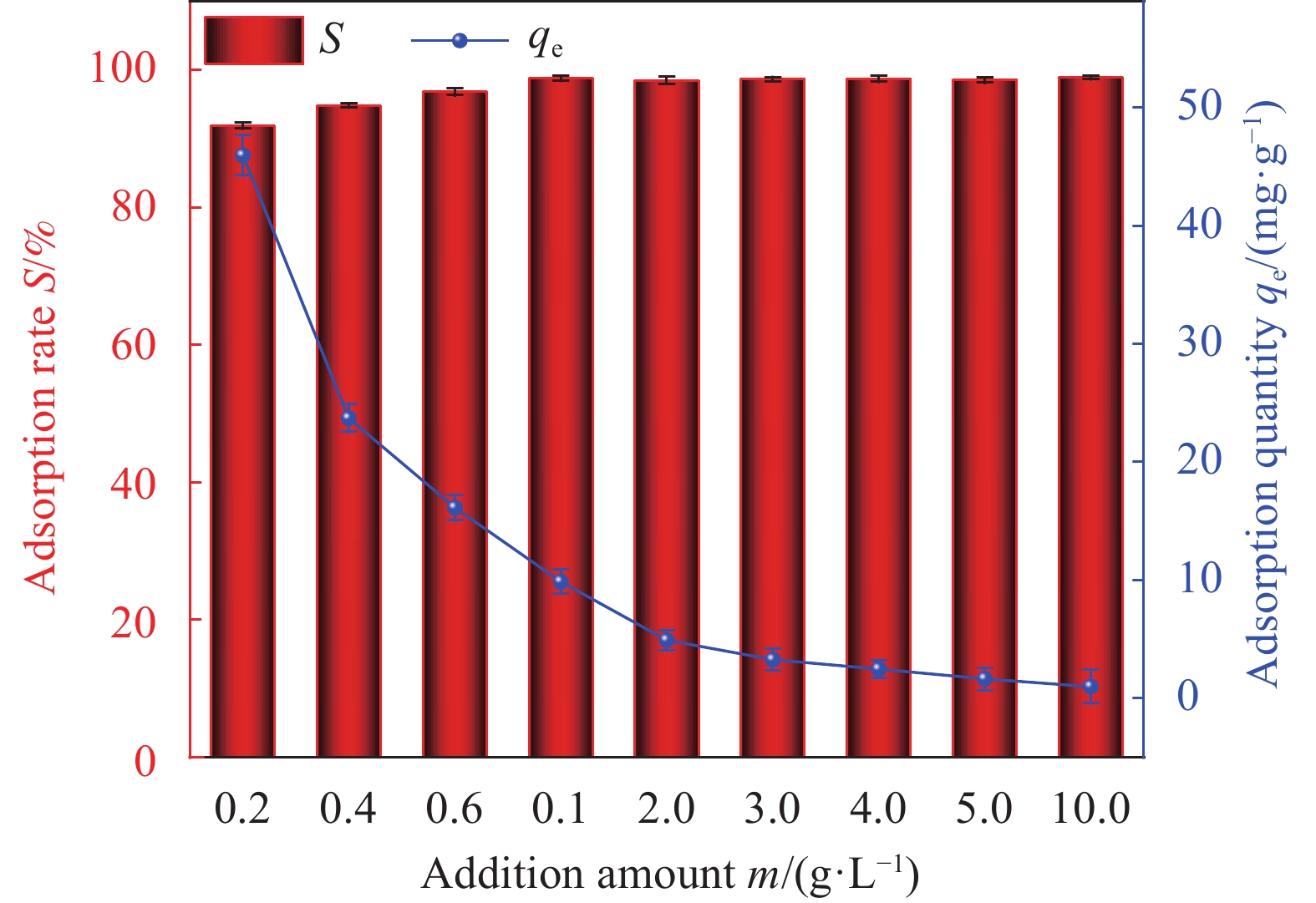
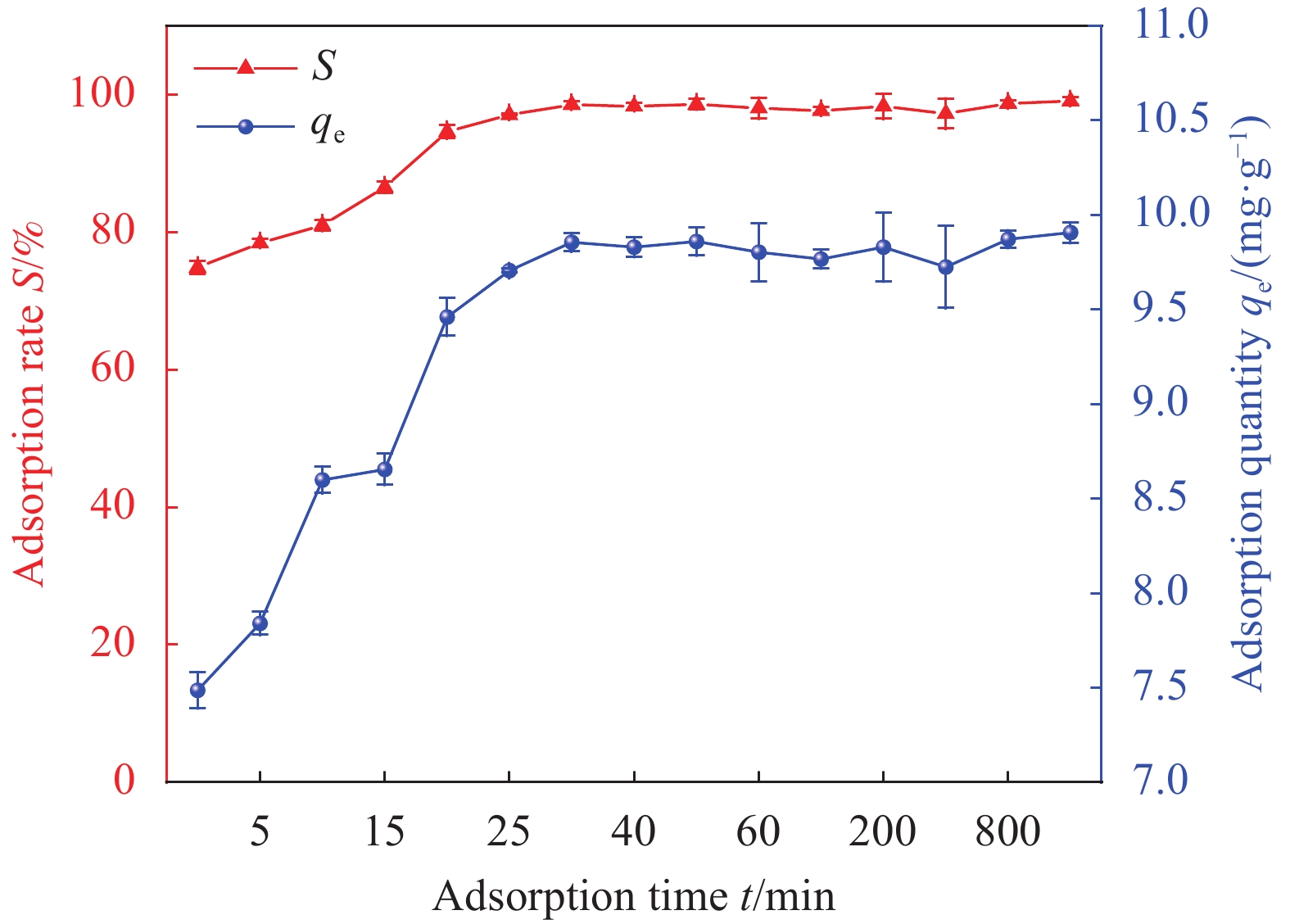
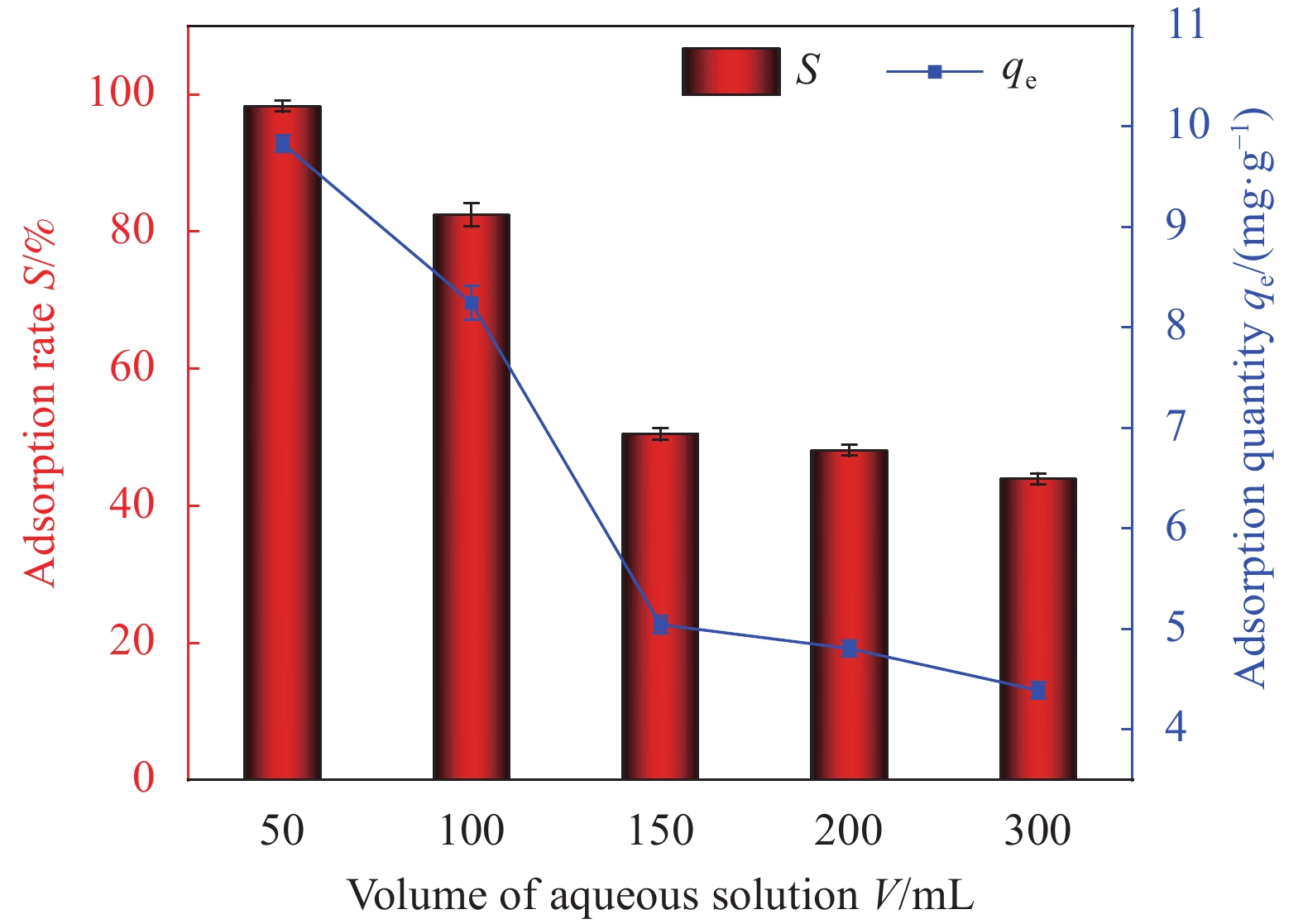
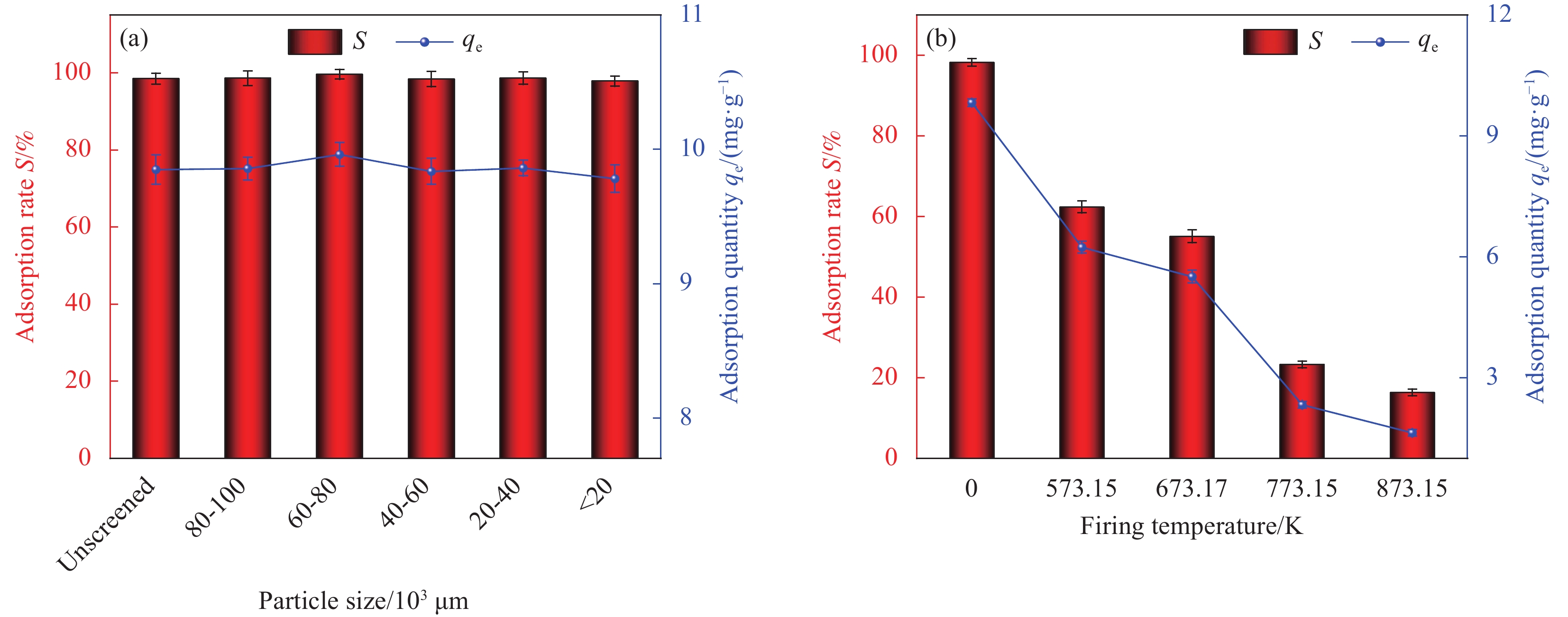
Factor A B C D E 1 2 0 298.15 0.01 1 2 6 60 308.15 0.02 10 3 11 100 318.15 0.05 30 Notes: A—pH of aqueous solution; B—Revolution speed (r·min−1); C—Temperature (K); D—Addition amount (g); E—Adsorption time (min). 表 2 HAP/BTN吸附铀的正交试验设计方案和结果
Table 2 Orthogonal experimental design and results of HAP/BTN adsorption of uranium
Factor A B C D E S/% 1 2 0 298.15 0.01 1 18.55 2 2 60 308.15 0.02 10 22.32 3 2 100 318.15 0.05 30 24.26 4 6 0 298.15 0.02 10 46.30 5 6 60 308.15 0.05 30 92.05 6 6 100 318.15 0.01 1 71.51 7 11 0 308.15 0.01 30 50.05 8 11 60 318.15 0.02 1 40.76 9 11 100 298.15 0.05 10 70.63 10 2 0 318.15 0.05 10 23.56 11 2 60 298.15 0.01 30 26.78 12 2 100 308.15 0.02 1 20.13 13 6 0 308.15 0.05 1 44.25 14 6 60 318.15 0.01 10 86.12 15 6 100 298.15 0.02 30 99.48 16 11 0 318.15 0.02 30 53.26 17 11 60 298.15 0.05 1 42.14 18 11 100 308.15 0.01 10 74.42 K1 135.6 235.97 303.88 327.43 237.34 — K2 439.71 310.17 303.22 282.25 323.35 — K3 331.26 360.43 299.47 296.89 345.88 — k1 45.20 78.66 101.29 109.14 79.11 — k2 146.57 103.39 101.07 94.08 107.78 — k3 110.42 120.14 99.823 98.96 115.29 — R 101.37 41.48 1.47 15.06 36.18 — Primary and secondary order A>B>E>D>C Notes: Ki—The ith (i=1,2,3) level of the factor is the test index.; ki—Average value of Ki; R—Range. 表 4 HAP/BTN吸附铀的动力学模型参数
Table 4 HAP/BTN kinetic fitting data
Model types Equation qe/
(mg·g−1)R2 Pseudo first-order model ln(qe−qt)=−0.10035t+1.26104 3.53 0.911 Pseudo second-order model t/q=0.09797t+0.14599 9.98 0.997 Elovich model qt=0.87196 lnt+6.80159 — 0.981 Morrist intraparticle diffusion model qt=0.67023t1/2+6.52163 — 0.930 qt=0.62663t1/2+6.50141 — 0.961 qt=0.299508t1/2+7.78542 — 0.956 表 3 HAP/BTN吸附铀的吸附等温线参数
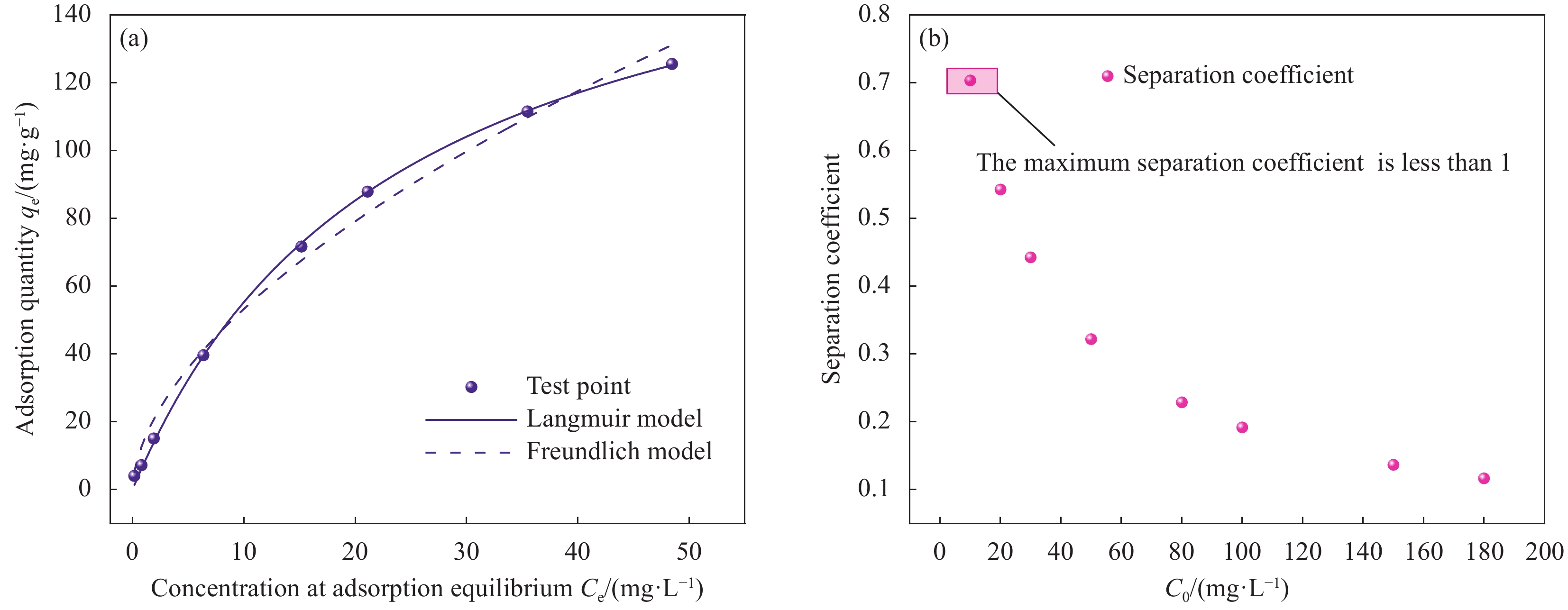
Table 3 Adsorption isotherm parameters of HAP/BTN adsorbing uranium
T Langmuir Freundlich qm/
(mg·g−1)Kc/
(L·mg−1)R2 n−1 Kf
/((mg·g−1)·(mg·L−1)−1/n)R2 273.15 K 186.45 0.04215 0.99992 0.57112 14.29826 0.91888 Notes: qm—Saturated adsorption capacity of monolayer adsorption; Kc—Constant related to adsorption energy; Kf —Constant related to the adsorption capacity; n−1—Measure of the adsorption strength; R2—Correlation coefficient. 表 5 HAP/BTN对铀(VI)的吸附热力学具体参数
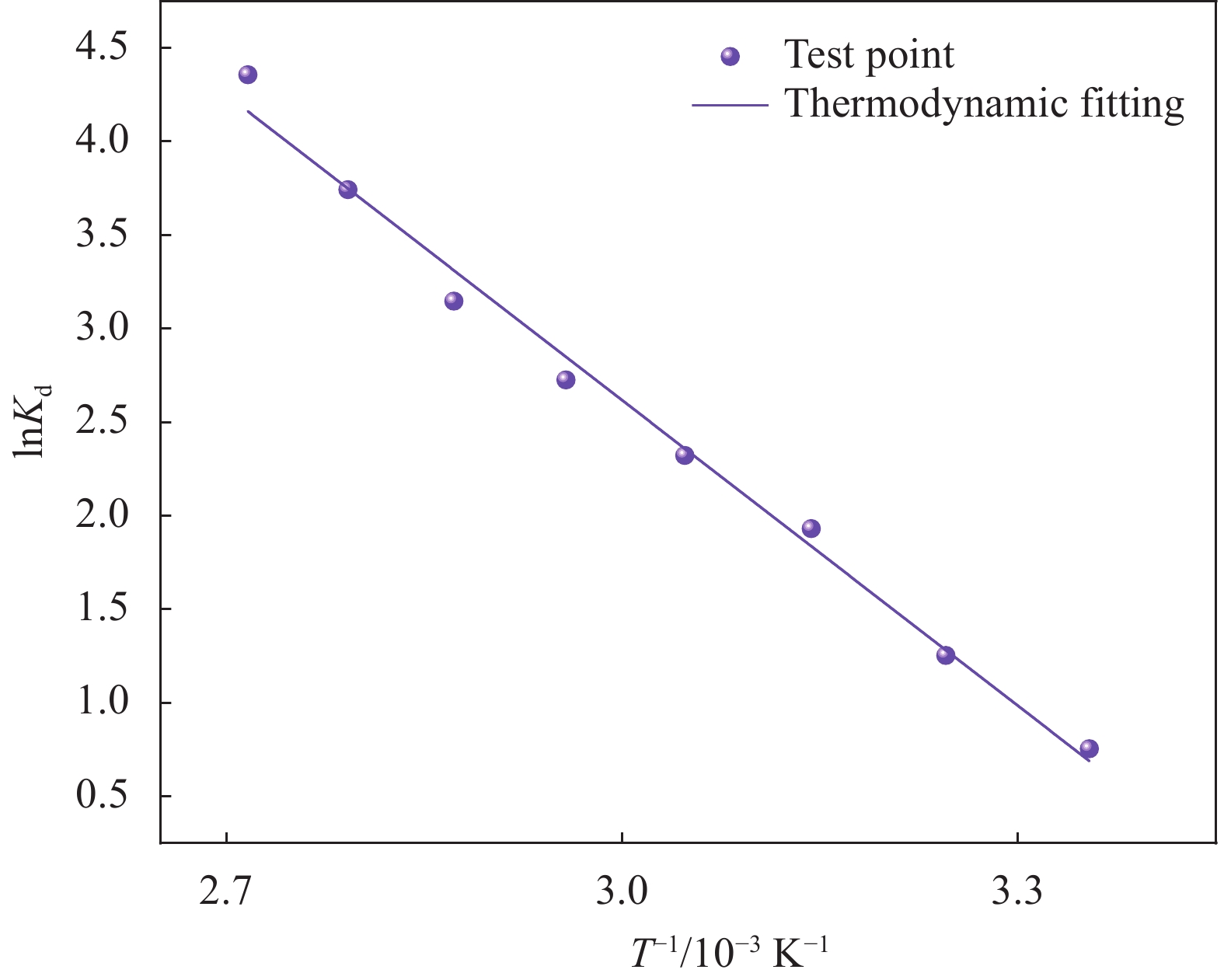
Table 5 Thermodynamic parameters of uranium (VI) adsorption on HAP/BTN
T/K ΔHθ/
(KJ·mol−1)ΔSθ/
(J·mol−1·K−1)ΔGθ/
(KJ·mol−1)298.15 45.27 157.58 −1.71 308.15 −3.29 318.15 −4.86 328.15 −6.44 338.15 −8.01 348.15 −9.59 358.15 −11.16 368.15 −12.76 Notes: ΔHθ—Heat of the adsorption; ΔSθ—Standard entropy change; ΔGθ—Gibbs free energy of adsorption. -
[1] 荣丽杉, 夏麟, 周书葵, 等. UiO-66/壳聚糖的制备及其对U(VI)的吸附机制[J]. 复合材料学报, 2022, 39(10):4879-4888. DOI: 10.13801/j.cnki.fhclxb.20211025.002 RONG Lishan, XIA Lin, ZHOU Shukui, et al. Preparation of UiO-66/chitosan and its adsorption mechanism of U(VI)[J]. Acta Materiae Compositae Sinica,2022,39(10):4879-4888(in Chinese). DOI: 10.13801/j.cnki.fhclxb.20211025.002
[2] SALEH T A, TUZEN M, SARI A. Polyethylenimine modified activated carbon as novel magnetic adsorbent for the removal of uranium from aqueous solution[J]. Chemical Engineering Research and Design,2017,117:218-227. DOI: 10.1016/j.cherd.2016.10.030
[3] BILAL M, IHSANULLAH I, YOUNAS M, et al. Recent advances in applications of low-cost adsorbents for the removal of heavy metals from water: A critical review[J]. Separation and Purification Technology,2021,278:119510. DOI: 10.1016/j.seppur.2021.119510
[4] LIU J, SHI S L, LI C, et al. U(VI) adsorption by one-step hydrothermally synthesized cetyltrimethylammonium bromide modified hydroxyapatite-bentonite composites from phosphate-carbonate coexisted solution[J]. Applied Clay Science,2021,203:106027. DOI: 10.1016/j.clay.2021.106027
[5] 马磊, 黄毅, 邓浩, 等. 氟磷灰石对酸性水溶液中铀(VI)的去除研究[J]. 无机材料学报, 2022, 37(4):395-405. DOI: 10.15541/jim20210255 MA Lei, HUANG Yi, DENG Hao, et al. Removal of uranium(VI) from acidic aqueous solution by fluorapatite[J]. Journal of Inorganic Materials,2022,37(4):395-405(in Chinese). DOI: 10.15541/jim20210255
[6] 张益硕, 周仲魁, 杨顺景, 等. 重金属污染土壤修复原理与技术[J]. 有色金属(冶炼部分), 2022(10):124-134. ZHANG Yishuo, ZHOU Zhongkui, YANG Shunjing, et al. Principles and technologies for remediation of heavy metal contaminated soil[J]. Nonferrous Metals (Extractive Metallurgy),2022(10):124-134(in Chinese).
[7] ORTABOY S, ACAR E T, ATUN G, et al. Performance of acrylic monomer based terpolymer/montmorillonite nanocomposite hydrogels for U(VI) removal from aqueous solutions[J]. Chemical Engineering Research and Design,2013,91(4):670-680. DOI: 10.1016/j.cherd.2012.12.007
[8] 于静, 王建龙. 无机吸附材料处理放射性废水中铀的研究进展[J]. 核化学与放射化学, 2018, 40(2):81-88. DOI: 10.7538/hhx.2018.40.02.0081 YU Jing, WANG Jianlong. Research advances in inorganic adsorption materials processing for uranium from radioactive wastewater[J]. Journal of Nuclear and Radioche-mistry,2018,40(2):81-88(in Chinese). DOI: 10.7538/hhx.2018.40.02.0081
[9] 熊小红, 林周梁, 王魏, 等. 铁钛柱撑膨润土吸附水中U(Ⅵ)的性能研究[J]. 铀矿冶, 2018, 37(4): 296-303. XIONG Xiaohong, LIN Zhouliang, WANG Wei, et al. Charateristics study on removal of U(Ⅵ) from aqueous solution by iron and titanium pillared bentonite adsorption[J]. Uranium Mining and Metallurgy, 2018, 37(4): 296-303(in Chinese).
[10] CHEN X, LI P, ZENG X, et al. Efficient adsorption of methylene blue by xanthan gum derivative modified hydroxyapatite[J]. International Journal of Biological Macromolecules,2020,151:1040-1048. DOI: 10.1016/j.ijbiomac.2019.10.145
[11] 刘国, 徐丽莎, 李知可, 等. 羟基磷灰石/膨润土复合材料对水中Cd2+吸附研究[J]. 硅酸盐学报, 2018, 46(10):1414-1425. LIU Guo, XU Lisha, LI Zhike, et al. Adsorption of cadmium on hydroxyapatite/bentonite composites in aqueous solution[J]. Journal of the Chinese Ceramic Society,2018,46(10):1414-1425(in Chinese).
[12] 王丝雨, 周仲魁, 张益硕, 等. 十二烷基三甲基溴化铵膨润土处理低浓度U(Ⅵ)废水试验研究[J]. 中国有色冶金, 2022, 51(5):128-136. DOI: 10.19612/j.cnki.cn11-5066/tf.2022.05.018 WANG Siyu, ZHOU Zhongkui, ZHANG Yishuo, et al. Removal of low concentration U(VI) in wastewater by dodecyl trimethyl ammonium bromide-modified bentonite[J]. China Nonferrous Metallurgy,2022,51(5):128-136(in Chinese). DOI: 10.19612/j.cnki.cn11-5066/tf.2022.05.018
[13] 张益硕, 周仲魁, 王丝雨, 等. STAC改性有机膨润土去除水体中U(Ⅵ)试验[J]. 有色金属(冶炼部分), 2022(1):127-132. ZHANG Yishuo, ZHOU Zhongkui, WANG Siyu, et al. Study on removal of U(Ⅵ) from water bodies by STAC modified bentonite[J]. Nonferrous Metals (Extractive Metallurgy),2022(1):127-132(in Chinese).
[14] 张益硕, 周仲魁, 杨顺景, 等. 用CTAB改性膨润土从低浓度废水中吸附去除U(Ⅵ)[J]. 湿法冶金, 2022, 41(2):145-149. DOI: 10.13355/j.cnki.sfyj.2022.02.011 ZHANG Yishuo, ZHOU Zhongkui, YANG Shunjing, et al. Adsorption of low concentration U(Ⅵ) in wastewater with CTAB modified bentonite[J]. Hydrometallurgy of China,2022,41(2):145-149(in Chinese). DOI: 10.13355/j.cnki.sfyj.2022.02.011
[15] 张益硕, 周仲魁, 杨顺景, 等. KH550改性膨润土对低浓度U(Ⅵ)的吸附[J]. 有色金属工程, 2022, 12(9):154-164. DOI: 10.3969/j.issn.2095-1744.2022.09.21 ZHANG Yishuo, ZHOU Zhongkui, YANG Shunjing, et al. Adsorption performance of KH550 modified bentoniteat low concentrations of U(Ⅵ)[J]. Nonferrous Metals Engi-neering,2022,12(9):154-164(in Chinese). DOI: 10.3969/j.issn.2095-1744.2022.09.21
[16] LEI Y, LI K, LIAO J, et al. Design of 3D alumina-doped magnesium oxide aerogels with a high efficiency removal of uranium (Ⅵ) from wastewater[J]. Inorganic Chemistry Frontiers,2021,8(10):2561-2574. DOI: 10.1039/D1QI00259G
[17] LIAO D X, ZHENG W, LI X M, et al. Removal of lead(II) from aqueous solutions using carbonate hydroxyapatite extracted from eggshell waste[J]. Journal of Hazardous Materials,2010,177(1-3):126-130. DOI: 10.1016/j.jhazmat.2009.12.005
[18] KOŁODYŃSKA D, WNĘTRZAK R, LEAHY J J, et al. Kinetic and adsorptive characterization of biochar in metal ions removal[J]. Chemical Engineering Journal,2012,197:295-305. DOI: 10.1016/j.cej.2012.05.025
[19] MEI D C, LIU L J, YAN B. Adsorption of uranium (VI) by metal-organic frameworks and covalent-organic frameworks from water[J]. Coordination Chemistry Reviews,2023,475:214917. DOI: 10.1016/j.ccr.2022.214917
[20] 李鑫璐, 赵建海, 王康, 等. 氢氧化镁改性活性炭对Cu(Ⅱ)的吸附[J]. 精细化工, 2020, 37(1): 130-134, 146. LI Xinlu, ZHAO Jianhai, WANG Kang, et al. Magnesium hydroxide modified activated carbon for the adsorption of copper (Ⅱ) ions[J]. Fine Chemicals, 2020, 37 (1): 130-134, 146(in Chinese).
[21] LIU H J, FU T Y, MAO Y B. Metal-organic framework-based materials for adsorption and detection of uranium (VI) from aqueous solution[J]. ACS Omega,2022,7(17):14430-14456. DOI: 10.1021/acsomega.2c00597
[22] ZHONG Z P, LI J F, MA Y Y, et al. The adsorption mechanism of heavy metals from coal combustion by modified kaolin: Experimental and theoretical studies[J]. Journal of Hazardous Materials,2021,418:126256. DOI: 10.1016/j.jhazmat.2021.126256
[23] HUANG R, WANG B, YANG B. Equilibrium, kinetic and thermodynamic studies of adsorption of Cd(II) from aqueous solution onto HACC-bentonite[J]. Desalination: The International Journal on the Science and Technology of Desalting and Water Purification,2011,280(1/3):297-304.
[24] 何豪, 朱宗强, 刘杰, 等. 镁-钙羟基磷灰石吸附剂对水中Pb2+的去除[J]. 环境科学, 2019, 40(9):4081-4090. DOI: 10.13227/j.hjkx.201901082 HE Hao, ZHU Zongqiang, LIU Jie, et al. Removal of Pb2+ from aqueous solution by magnesium-calcium hydroxyapatite adsorbent[J]. Environmental Science,2019,40(9):4081-4090(in Chinese). DOI: 10.13227/j.hjkx.201901082
[25] XIONG T, JIA L, LI Q, et al. Efficient removal of uranium by hydroxyapatite modified kaolin aerogel[J]. Separation and Purification Technology,2022,299:121776. DOI: 10.1016/j.seppur.2022.121776
[26] TAN W T, ZHOU H, TANG S F, et al. Enhancing Cd(II) adsorption on rice straw biochar by modification of iron and manganese oxides[J]. Environmental Pollution,2022,300:118899. DOI: 10.1016/j.envpol.2022.118899
[27] LANGMUIR I. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. Journal of the American Chemical Society, 1918, 40(9): 1361-1403.
[28] WU L, YANG X, CHEN T, et al. Three-dimensional C3 N5/RGO aerogels with enhanced visible-light response and electron-hole separation efficiencyfor photocatalytic uranium reduction[J]. Chemical Engineering Journal,2022,427:131773. DOI: 10.1016/j.cej.2021.131773
[29] CHEN X D, LI W T, ZHANG G X, et al. Highly stable and activated cerium-based MOFs superstructures for ultrahigh selective uranium (VI) capture from simulated seawater[J]. Materials Today Chemistry,2022,23:100705. DOI: 10.1016/j.mtchem.2021.100705
[30] NKOH J N, HONG Z, LU H, et al. Alonite and gibbsite: Adsorption isotherms and spectroscopic analysis[J]. Applied Clay Science,2022,219:106437. DOI: 10.1016/j.clay.2022.106437
[31] YIN Y, XU G Y, XU Y X, et al. Adsorption of inorganic and organic phosphorus onto polypyrrole modified red mud: Evidence from batch and column experiments[J]. Chemosphere,2022,286:131862. DOI: 10.1016/j.chemosphere.2021.131862
[32] LIAO J, DING L, ZHANG Y, et al. Efficient removal of uranium from wastewater using pig manure biochar: Understanding adsorption and binding mechanisms[J]. Journal of Hazardous Materials,2022,423:127190. DOI: 10.1016/j.jhazmat.2021.127190
[33] WU Y H, CHEN D Y, KONG L, et al. Rapid and effective removal of uranium (VI) from aqueous solution by facile synthesized hierarchical hollow hydroxyapatite microspheres[J]. Journal of Hazardous Materials,2019,371:397-405. DOI: 10.1016/j.jhazmat.2019.02.110
[34] CHEN L, WANG Y Q, CAO X H, et al. Effect of doping cation on the adsorption properties of hydroxyapatite to uranium[J]. Journal of Solid State Chemistry,2023,317:123687. DOI: 10.1016/j.jssc.2022.123687
[35] 王玉罡, 张卫民, 陈家鸿, 等. 钙铁基磷酸盐复合材料(CFP(CC))对U(Ⅵ)的吸附性能[J]. 材料导报, 2022, 36(14): 116-123. WANG Yugang, ZHANG Weimin, CHEN Jiahong, et al. Adsorption performance of Ca/Fe-phosphate composites (CFP(CC)) on U(Ⅵ) [J]. Materials Reports, 2022, 36 (14): 116-123(in Chinese).
[36] 王光辉, 胡苏杭, 韩晨. 半胱氨酸盐酸盐改性膨润土对铀的吸附研究[J]. 日用化学工业, 2014, 44(3): 126-130. WANG Guanghui, HU Suhang, HAN Chen. Study on adsorption of uranium onto bentonite modified by cysteine hydrochloride[J]. China Surfactant Detergent & Cosmetics, 2014, 44 (3): 126-130(in Chinese).
[37] 尹英杰, 楚龙港, 朱司航, 等. 表面活性剂改性纳米羟基磷灰石对Cd2+吸附研究[J]. 农业环境科学学报, 2019, 38(8): 1901-1908. YIN Yingjie, CHU Longgang, ZHU Sihang, et al. Adsorption capacity of surfactant-modified nano-hydroxyapatite for Cd2+ [J]. Journal of Agro-Environment Science, 2019, 38 (8): 1901-1908(in Chinese).
-
期刊类型引用(3)
1. 李梦涵,魏娜,徐瑞琪,杨泽钰,崔洪芝. 三维碳纳米管/硅藻土基多孔陶瓷复合材料的制备及其光热水蒸发性能. 复合材料学报. 2023(08): 4577-4586 .  本站查看
本站查看
2. 吴玉萍,王乾廷,孙炜,周忠华,谢宗丽,宋铭雨. 含椭圆叶片状SiO_2/聚乙烯醇渗透汽化复合膜的制备与性能. 复合材料学报. 2022(06): 2783-2791 .  本站查看
本站查看
3. 赵士雄. 反渗透复合膜制备及其改性方法研究进展. 云南化工. 2022(06): 20-21+38 .  百度学术
百度学术
其他类型引用(1)
-
目的
随着核能的快速发展,放射性元素的去除成为亟需解决的问题。铀作为一种放射性核素,它的危害具有化学毒性和放射性损伤。因此,高效去除水体中的铀污染对于环境安全具有十分重要的意义。本文利用复合材料具有协同效应的理论基础,设计出羟基磷灰石改性膨润土复合材料(HAP/BTN),并研究其对铀的去除性能能和吸附机制。
方法采用一步水热法合成HAP/BTN,后通过单因素试验和正交试验探究HAP/BTN对铀的吸附性能,借助吸附研究中常用的等温吸附模型、动力学模型及热力学模型对HAP/BTN吸附铀的数据进行拟合,并结合TEM、FTIR、XPS及XRD对HAP/BTN进行表征以揭示其特性及吸附机制。
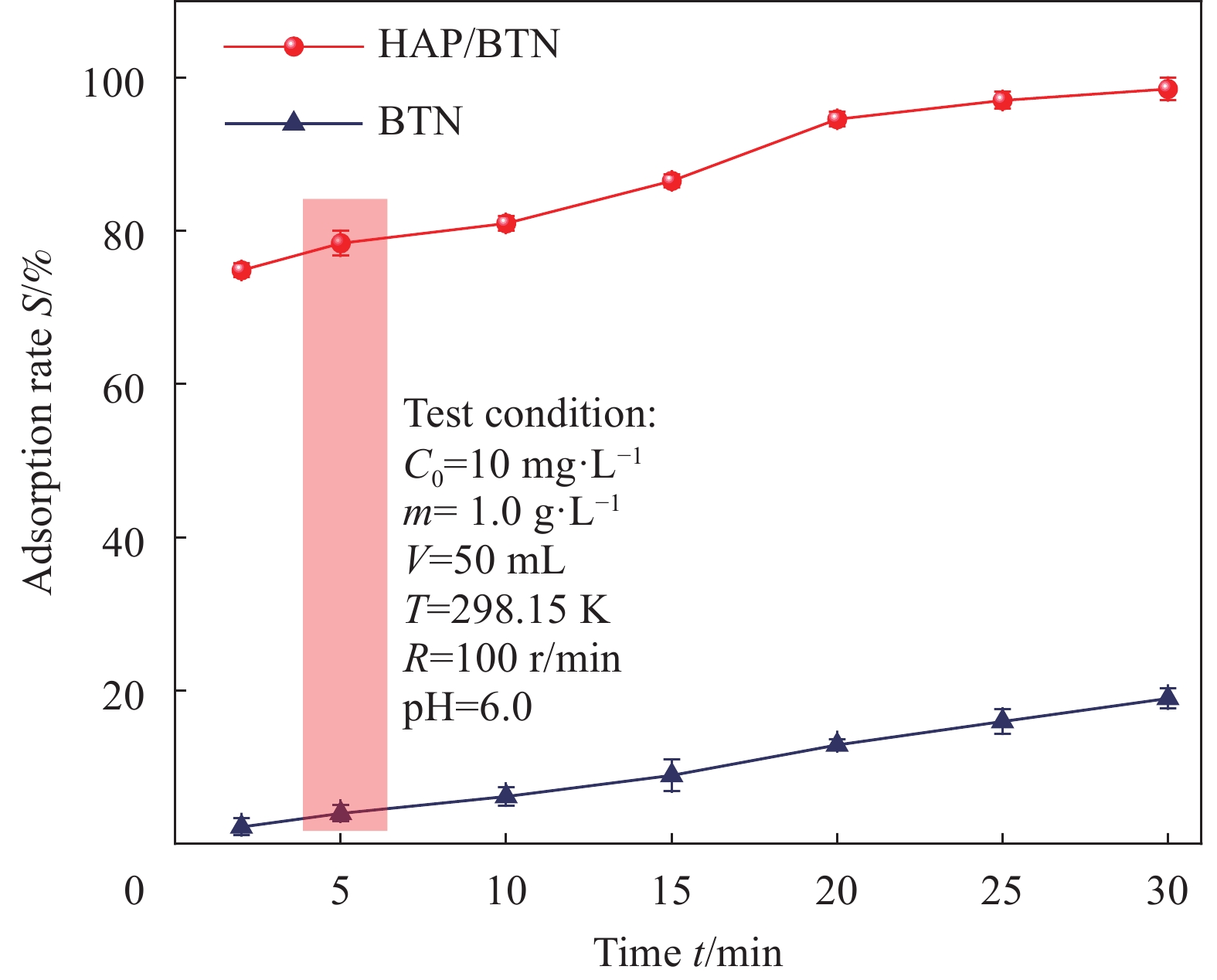
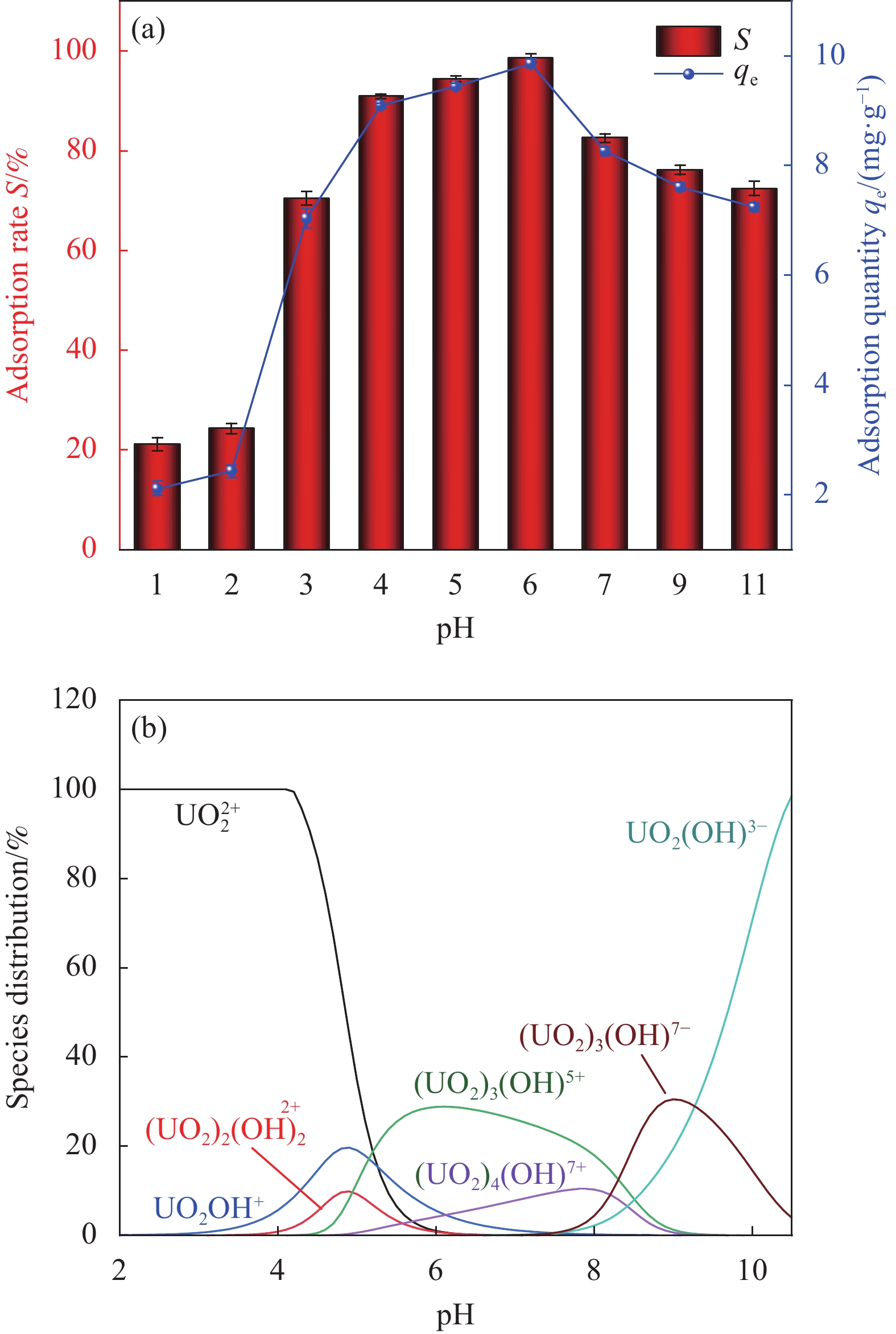
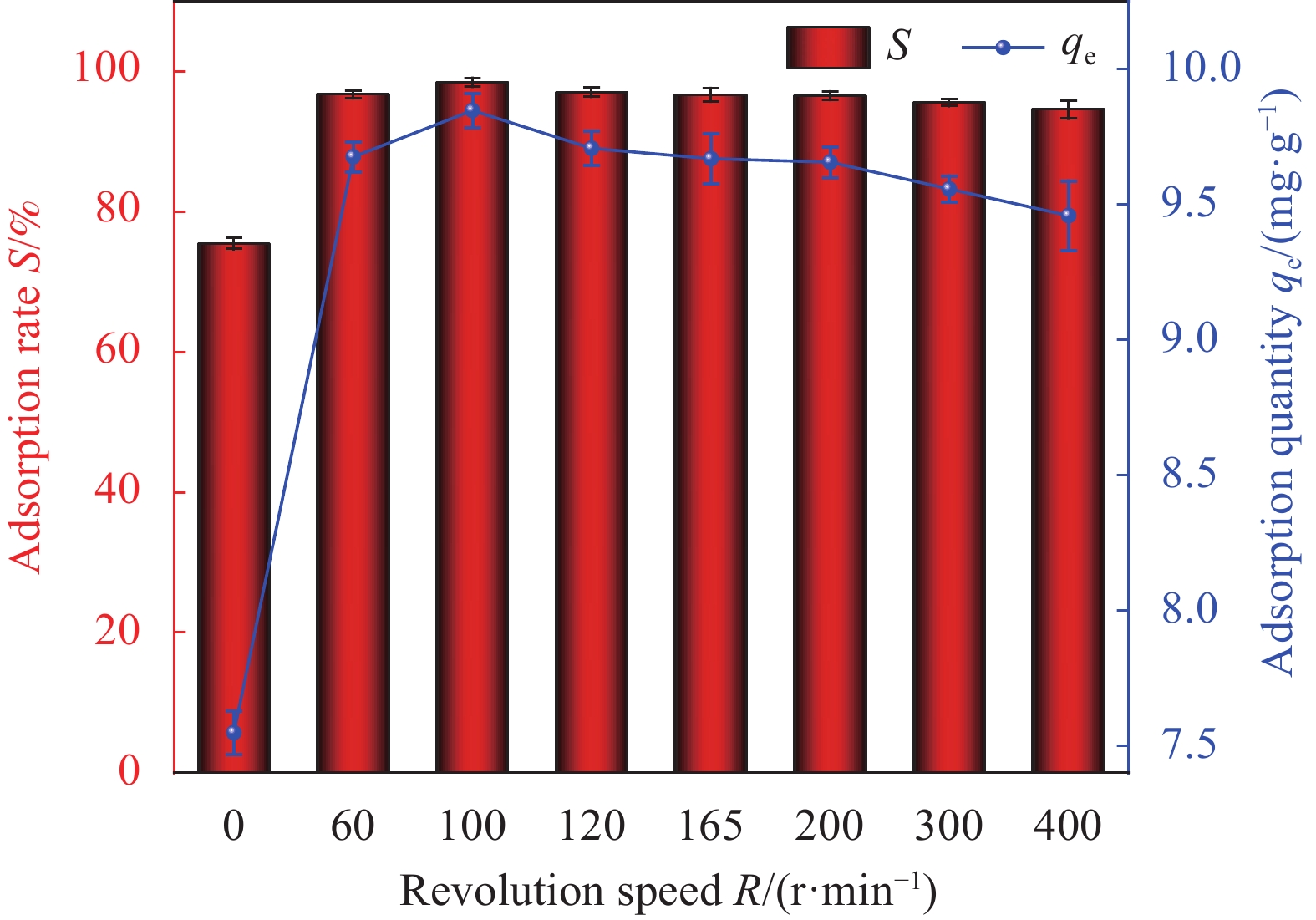
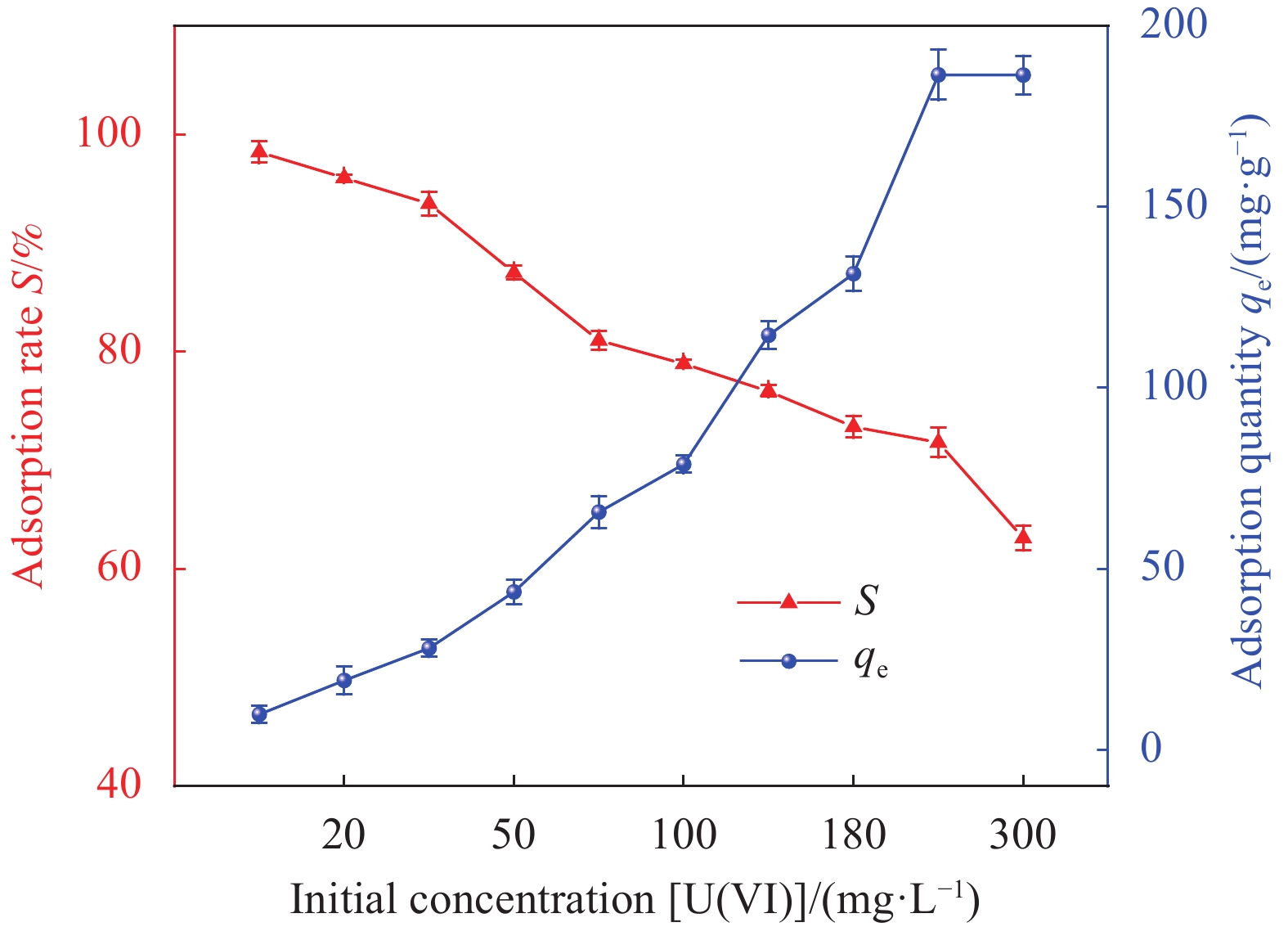
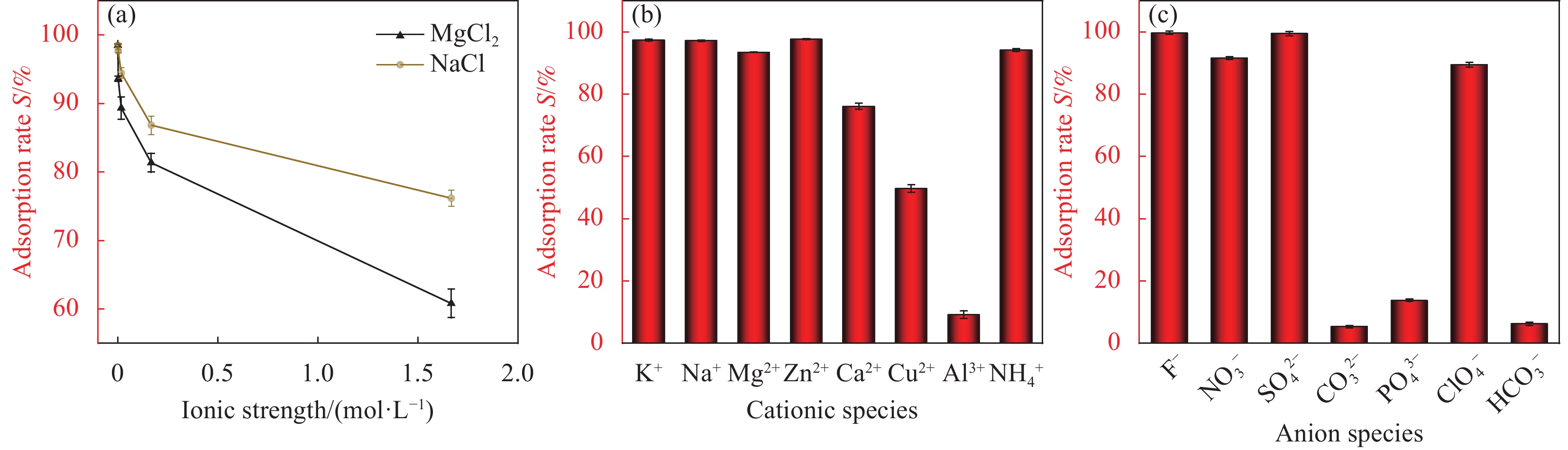
结果(1)采用一步水热合成法成功制备出一种新型环保可持续的含铀废水吸附材料(HAP/BTN),其主要成分为对人体及环境毒性较小的膨润土和羟基磷灰石。因此,HAP/BTN可以作为绿色含铀废水吸附材料。(2)在pH=6.0、转速=100 r/min、室温(298.15 K)、HAP/BTN投加量1 g/L(50 mL)、时间(30 min)时,该吸附材料对10 mg/L含铀废水的去除率可达98%左右,Langmuir拟合得出最大吸附量为186.45 mg/g。通过正交试验得出pH对其吸附影响较大,故需特别注意pH对吸附的影响。(3)准二级动力学和Langmuir模型更适合描述其对低浓度铀的吸附,得出其吸附过程应以单分子层化学吸附为主,热力学分析得出其对铀的吸附为自发的吸热过程。稳定性试验得出,该吸附材料具有较好的稳定性和吸附性能。(4)通过吸附等温方程得出HAP/BTN符合Langmuir模型,通过动力学分析得出HAP/BTN符合准二级动力学,通过热力学分析得出HAP/BTN对铀的吸附是一个自发吸热的过程。(5)采用0.1mol/L的硝酸作为HAP/BTN的解吸剂。重复利用五次的HAP/BTN对铀的去除率仍高于80 %,造成HAP/BTN在循环过程中去除率下降的原因可能为:循环中离心、洗涤等过程会导致材料质量的减少,解吸剂也可能会影响材料表面的官能团,HAP/BTN具有可回收性与循环稳定性,是一种具有广阔前景的含铀废水吸附材料。(6)在30 d的时间内HAP/BTN对含铀废水的去除率和吸附量无明显变化,40 d去除效果开始出现下降,即HAP/BTN吸附的铀发生了部分解吸,100 d时去除率仍高于80%,HAP/BTN吸附铀后可在30 d内保持吸附稳定,污染物解吸较少。(7)随着Na和Mg离子强度的增加,HAP/BTN对含铀废水的去除受到抑制,这可能是因为随着水体中离子强度的增加,Na和Mg与铀竞争HAP/BTN吸附位点的作用增强,进而影响HAP/BTN对铀的吸附。Mg对吸附影响更大的原因可能为:HAP/BTN的活性位点与价态高的阳离子之间的静电作用更强,因此,Mg对铀的去除率影响更明显。Ca、Cu及Al对HAP/BTN吸附铀的影响较大,这可能是因为价态较高,离子半径较大的金属离子与铀之间存在强烈竞争,在HAP/BTN对铀吸附过程中Ca、Cu及Al易占据铀的吸附位点。F与SO可以促进HAP/BTN对铀的吸附(去除率高于98.31 %),而HCO、CO与PO对铀的去除影响较大,这可能是因为其与铀形成UO(CO)和UOHPO的络合物不利于吸附的进行,且HCO还可能会产生H占据材料的吸附位点进而影响HAP/BTN对铀的吸附。(8)分析吸附机理得出络合反应、化学吸附、静电吸附和离子交换可能为HAP/BTN对铀的去除机制。
结论HAP/BTN以羟基磷灰石和膨润土为原料所制备,其对环境造成的二次污染较小且合成简单处理效果优异,可满足含铀废水绿色、高效、持续及经济的要求,具有继续深入研究的价值。后续的研究应将HAP/BTN用于实际含铀废水的吸附处理中,以考察其对实际含铀废水的耐受性,还可将HAP/BTN与磁性材料进行复合,组成易于回收的环境功能材料,进而扩大材料的应用范围。
-
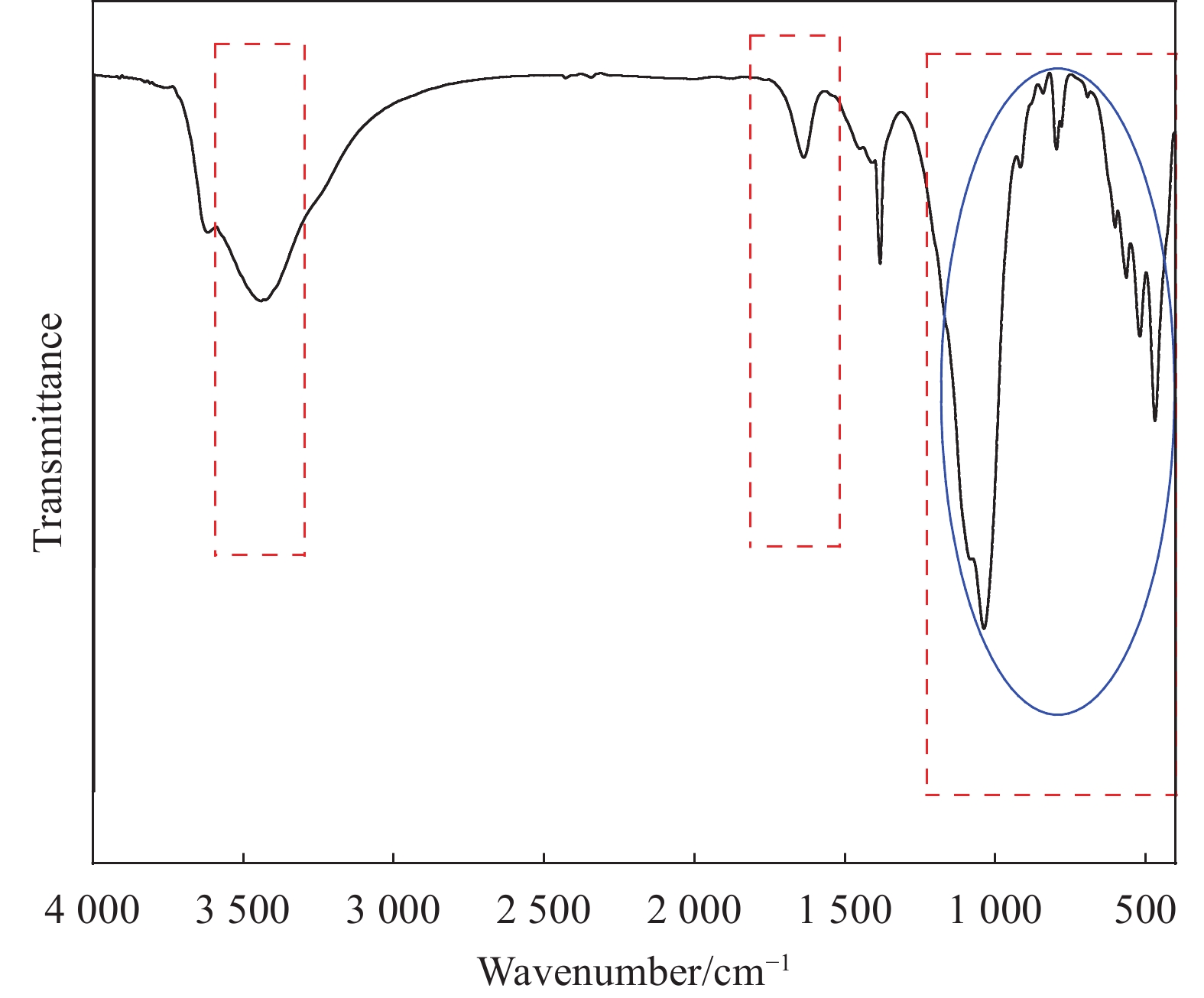
膨润土(BTN)的团聚性(
图1 )及缺少吸附官能团严重制约其对含铀废水的去除性能,需对其进行改性使其成为复合材料以提高膨润土的吸附性能。
TEM diagram of bentonite
本文以膨润土、磷酸氢二钠、硝酸钙为原料,采用简单易行的一步水热法成功制备出羟基磷灰石改性膨润土复合材料(HAP/BTN),即克服了膨润土的团聚性又使吸附材料的制备简单化,且由于HAP/BTN的组成为天然膨润土和羟基磷灰石,因此,其对环境产生的二次污染较小,提升了环境吸附材料的工业应用潜力。本工作采用较成熟的单因素试验和正交试验考察了HAP/BTN吸附铀的性能,得出其对铀的去除率可达98%,吸附等温线拟合得出其吸附量为186.45 mg/g,最后通过表征及Zeta电位分析得出其吸附机制如
图2 所示。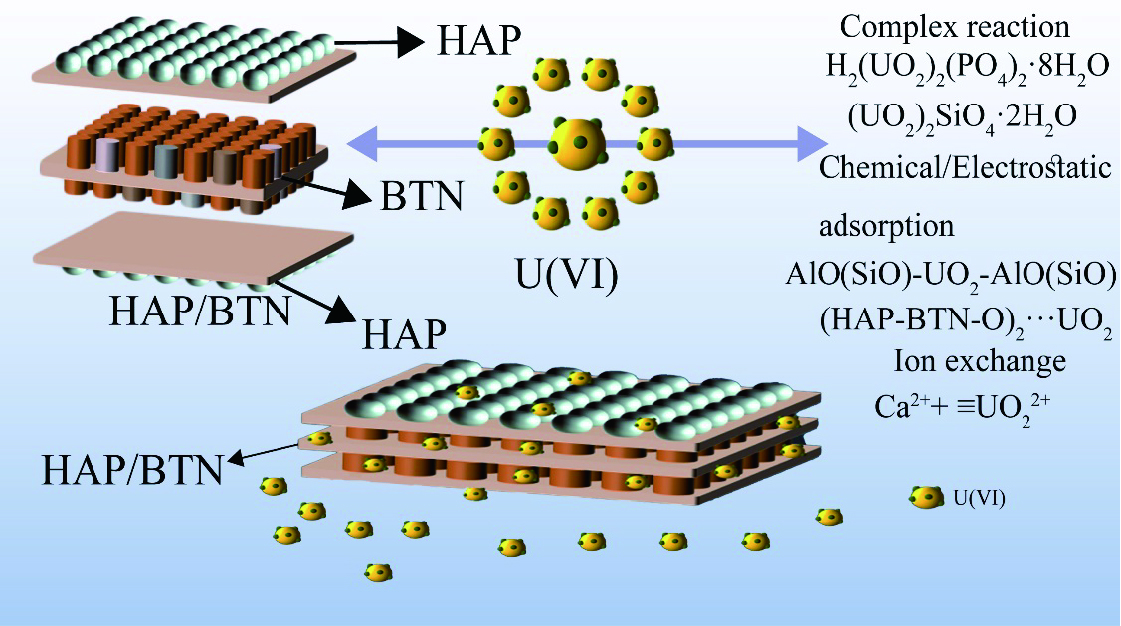
Mechanism of uranium adsorption by HAP/BTN





 下载:
下载: